
【题目】[化学——选修2:化学与技术]
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
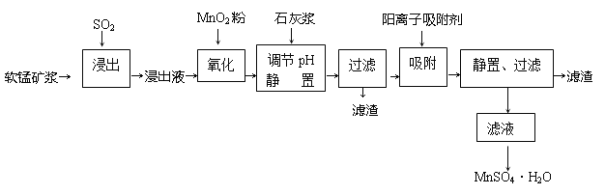
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。
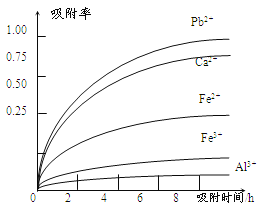
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图
离子 | 离子半径 (pm) | 开始沉淀时 的pH | 完全沉淀时 的pH |
Fe2+ | 74 | 7.6 | 9.7 |
Fe3+ | 64 | 2.7 | 3.7 |
Al3+ | 50 | 3.8 | 4.7 |
Mn2+ | 80 | 8.3 | 9.8 |
Pb2+ | 121 | 8.0 | 8.8 |
Ca2+ | 99 | - | - |
(1)浸出过程中生成Mn2+反应的化学方程式为___________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至_______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有______________________等(写二点)。
(5)吸附步骤除去的主要离子为___________________________。
(6)电解MnSO4 、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_______________。
【答案】(1)SO2+MnO2=MnSO4
(2)2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
(3)4.7≤pH<8.3(3分)
(4)吸附时间、金属离子半径、金属离子电荷
(5)Pb2+、Ca2+(2分);(6)Mn2+-2e-+2H2O=MnO2↓+4H+
【解析】
试题分析:(1)根据题意在浸出过程中生成Mn2+反应的化学方程式为SO2+MnO2=MnSO4;
(2)将Fe2+氧化为Fe3+过程中主要反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计。使Fe3+沉淀完全的pH为3.7,而Mn2+开始形成沉淀的pH为8.3,因此应调节pH的范围为4.7 ≤pH<8.3。
(4)根据题目提供的表格数据可知决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径 、金属离子的电荷;
(5)吸附步骤除去的主要离子为Pb2+、Ca2+;
(6)电解MnSO4 、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,Mn元素的化合价由+2价升高到+4价,失去2个电子发生氧化反应,用H+平衡电荷,用水配平原子,则该电解池的阳极的电极反应方程式为Mn2+-2e-+2H2O=MnO2↓+4H+。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】如右图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出。符合这一情况的是下表中的( )
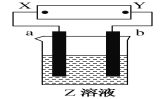
选项 | a极板 | b极板 | X极 | Z溶液 |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明醋酸是弱电解质的是
A. 醋酸溶液导电性差 B. 醋酸溶液中存在醋酸分子
C. 醋酸钠溶液呈碱性 D. 0.1 mol/L醋酸溶液的pH=2.9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A.足量铁在氯气中反应,1 mol铁失去的电子数为3 NA
B.6.4 g Cu与足量硫充分反应后,转移电子数为0.2 NA
C.密闭容器中2 mol NO与1 mol O2充分反应后,产物的分子数为NA
D.常温常压下,0.1 mol NH3与0.1 mol HCl充分反应后所得产物含0.1 NA个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
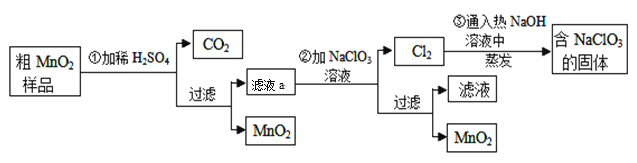
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)写出滤液a与NaClO3溶液反应的离子方程式: 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)该流程中可以循环利用的物质是 和 。
(5)若粗MnO2样品的质量为13.40g,加入稀H2SO4后,经过滤得到8.7g MnO2,并收集到0.224 L CO2(标准状况下),则滤液a与NaClO3溶液反应时至少需要 mol NaClO3才能将滤液a中的Mn2+完全转化为MnO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5 有机化学基础】某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
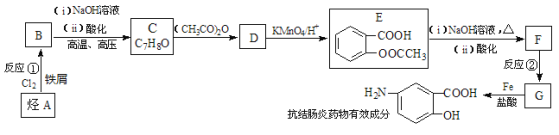
已知:
请回答下列问题:
(1)抗结肠炎药物有效成分的分子式是:_____________;烃A的名称为:_____________;反应②的反应类型是:___________________。
(2)①下列对该抗结肠炎药物有效成分可能具有的性质推测正确的是:____________;
A.水溶性比苯酚好 B.能发生消去反应也能发生聚合反应
C.1mol该物质最多可与4mol H2发生反应 D.既有酸性又有碱性
② E与足量NaOH溶液反应的化学方程式是:_______________________。
(3)符合下列条件的抗结肠炎药物有效成分的同分异构体有________种。
A.遇FeCl3溶液有显色反应 B.分子中甲基与苯环直接相连 C.苯环上共有三个取代基
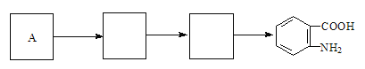
(4)已知:苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此按先后顺序写出以A为原料合成邻氨基苯甲酸(![]() )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如下图所示:
下列描述正确的是
A.反应开始到10 s,用Z表示的反应速率为0.158 molL-1s-1
B.反应开始到10 s,X的物质的量浓度为减少了0.79 molL-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g) + Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com