
【题目】不能说明醋酸是弱电解质的是
A. 醋酸溶液导电性差 B. 醋酸溶液中存在醋酸分子
C. 醋酸钠溶液呈碱性 D. 0.1 mol/L醋酸溶液的pH=2.9
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】COCl2(g) ![]() CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
A.①④⑥⑦ B.①④⑥ C.①②④⑦ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组离子是( )
A. Fe3+、Al3+、CO32—、Cl— B. K+、Cu2+、OH—、NO3—
C. NH4+、Na+、Br—、SO42— D. Mg2+、H+、SiO32—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1
②H2O(l)=H2O(g) △H=+44.0kJ·mol-1
写出表示甲醇燃烧热的热化学方程式 。
II.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H>0
CO2(g)+3H2(g) △H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反映前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号) 。
① v正(CH3OH)=3v逆(H2)
混合气体的密度不变
混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)右图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
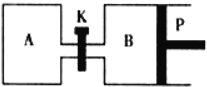
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液的酸碱性可用酸度(AG)表示,已知AG =lg![]() ,室温下将0.01molL﹣l盐酸逐滴滴入20.00mL 0.01 molL﹣l氨水中,溶液的AG变化如图所示,下列说法正确的是
,室温下将0.01molL﹣l盐酸逐滴滴入20.00mL 0.01 molL﹣l氨水中,溶液的AG变化如图所示,下列说法正确的是
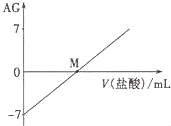
A.室温下,0.01 molL﹣l盐酸的AG=12
B.M点时溶液中:c(NH4+)=c(Cl﹣)
C.M点加入盐酸的体积大于20.00 mL
D.M点以后NH4+的水解程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 铁与稀H2SO4反应时,加入少量CuSO4溶液,可使反应速率加快
B. 构成原电池的正极和负极必须是两种不同的金属
C. 在铁上镀铜时,金属铜作阴极
D. 用惰性电极电解CuSO4溶液,溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是

甲 | 乙 | 丙 | 戊 | |
① | SiO2 | NaOH | Na2SiO3 | CO2 |
② | Fe | H2O | Fe2O3 | H2 |
③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
④ | Na2O2 | CO2 | O2 | Na |
A.①③ B.①② C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
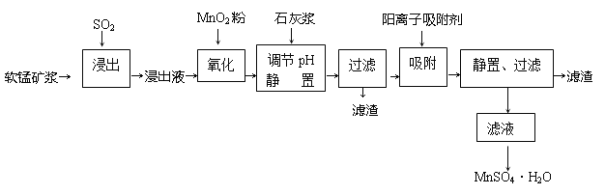
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。
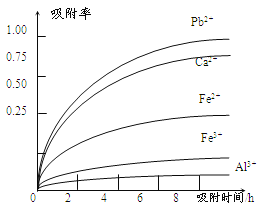
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图
离子 | 离子半径 (pm) | 开始沉淀时 的pH | 完全沉淀时 的pH |
Fe2+ | 74 | 7.6 | 9.7 |
Fe3+ | 64 | 2.7 | 3.7 |
Al3+ | 50 | 3.8 | 4.7 |
Mn2+ | 80 | 8.3 | 9.8 |
Pb2+ | 121 | 8.0 | 8.8 |
Ca2+ | 99 | - | - |
(1)浸出过程中生成Mn2+反应的化学方程式为___________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至_______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有______________________等(写二点)。
(5)吸附步骤除去的主要离子为___________________________。
(6)电解MnSO4 、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
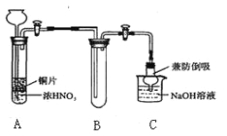
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的小木条迅速伸进试管内,发现木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的。为准确达到实验目的,需在A、B之间增加一个装置,该装置的作用是 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:①2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2SO4+2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①B中观察到的主要现象是 ,F装置的作用是 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③充分反应后,检验D装置中反应产物的实验方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com