
【题目】下列说法正确的是( )
A.物质发生化学变化都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.伴有能量变化的物质变化都是化学变化
D.热化学方程式的计量数可以表示分子的个数
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】3.6g烃A和Cl2发生取代反应,控制条件使其生成一氯代物,将反应生成的气体用NaOH溶液中和恰好和0.1molL﹣1NaOH溶液500mL完全反应,试解答下列问题:
(1)求链烃A的相对分子质量 .
(2)若A既不能使酸性KMnO4溶液褪色又不能使溴水褪色,试求该烃的分子式 , 并写出符合该分子式的所有可能的同分异构体的结构简式 .
(3)若A的一氯代物只有一种,试确定A的结构简式并用系统命名法命名、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质及其化合物在生产、生活中有着重要的用途。回答下列问题:
(1)直链低聚磷酸盐的化学式可表示为M(n+2)PnOx(M为+1价金属离子),则x=(用n表示)。
(2)H3PO2及NaH2PO2具有较强还原性,均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①H3PO2是一元弱酸,写出其电离方程式:。NaH2PO2水溶液显(填“酸性”、“中性”、或者“碱性”)。
②H3PO2中,磷元素的化合价为 , 在碱性条件下,次磷酸盐可用于化学镀银,配平反应的离子方程式: ![]() +Ag+ +
+Ag+ + ![]()
![]() + Ag↓ +。
+ Ag↓ +。
(3)H3PO2可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式;
②分析产品室可得到H3PO2的原因;
③得到1 mol H3PO2的同时,阴极室制得NaOH质量为g。
(4)含磷(主要为H3PO4、磷酸盐等)废水需加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(PO43)=4×107 mol·L1 , 则溶液中c(Ca2+)=mol·L1。(已知Ksp[Ca3(PO4)2]=2×1029)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氯化钠晶体不导电是没有离子存在
B. 石墨能导电,但是石墨既不是电解质也不是非电解质
C. KNO3在电流作用下在水中电离出K+和NO3-
D. 液态氯化氢存在着自由移动的氯离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g)△H=﹣92.3kJmol﹣1 , 则反应2HCl(g)=H2(g)+Cl2(g)的△H为( )
A.+184.6kJmol﹣1
B.﹣92.3kJmol﹣1
C.﹣369.2kJmol﹣1
D.+92.3kJmol﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A. 铁与稀盐酸反应:2 Fe+6H+=2Fe3++3H2↑
B. 氢氧化钠溶液与盐酸反应:OH-+H+=H2O
C. 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu
D. 氯化钡溶液与稀硫酸反应:SO42-+Ba2+= BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(Ⅱ)酸钾{K2[Cu(C2O4)2]2H2O}制备流程如图1: 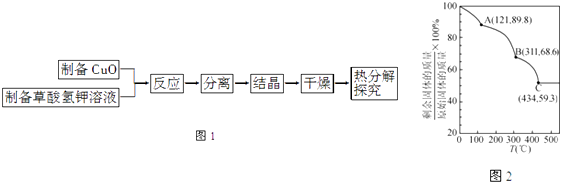
(已知H2C2O4 ![]() CO↑+CO2↑+H2O)
CO↑+CO2↑+H2O)
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤.①用双层滤纸的可能原因是 .
②用蒸馏水洗涤氧化铜时,如何证明已洗涤干净:
(2)本实验用K2CO3粉末与草酸溶液制取KHC2O4溶液而不用KOH粉末代替K2CO3粉末的可能原因是 .
(3)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中:;50℃水浴加热至反应充分,发生反应的化学方程式为;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得二草酸合铜(Ⅱ)酸钾晶体.
(4)若实验室只有含少量FeSO47H2O的硫酸铜晶体,欲制备较纯净的CuSO4溶液.
Ⅰ.相关数据(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 5.8 | 8.8 |
Ⅱ.提供的试剂有:a.蒸馏水 .稀硫酸 .H2O2溶液 d.纯净的Cu(OH)2粉末 .氨水
需经过的步骤有:①、②、③、④过滤得CuSO4溶液.
(5)将制得的K2[Cu(C2O4)2]2H2O进行热重分析,结果如图2,由图2知在C点剩余固体为K2CO3和 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com