
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.由C(石墨)=C(金刚石)ΔH=+11.9kJ/mol,可知金刚石比石墨稳定
C.我国目前使用的主要能源是化石燃料,属于不可再生能源
D.可表示氢气燃烧热的热化学方程式为H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,

现用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是__________。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 __________________。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是_______________。
(3)在装置C中应加入NaOH溶液,其目的是____________。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法 ______________。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置分层、分液后,若产物中有少量未反应的Br2,最好用______________洗涤除去;若产物中有少量副产物乙醚,可用________(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是________________。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,我国使用的能源主要是煤、石油、天然气等,这些能源都是不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。科学家预测氢能将是21世纪最理想的新能源之一。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较经济且资源可持续利用的制氢气的方法是________(填序号)。
A.电解水 B.锌和稀硫酸反应 C.光解海水
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:![]()
![]()
![]()
![]()
由甲烷制氢气的一个缺点是________。
(3)将![]() 进行热分解也可以制得氢气
进行热分解也可以制得氢气![]()
![]() 。热分解制氢气时,常向反应器中通入一定比例的空气,使部分
。热分解制氢气时,常向反应器中通入一定比例的空气,使部分![]() 燃烧,其目的是_________________________。
燃烧,其目的是_________________________。
(4)镁铝合金(![]() )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的![]() 、
、![]() 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为![]() 得到的混合物
得到的混合物![]() 在一定条件下可释放出氢气。
在一定条件下可释放出氢气。
①熔炼制备镁铝合金(![]() )时通入氩气的目的是____________________________________。
)时通入氩气的目的是____________________________________。
②在足量的![]() 的
的![]() 溶液中,混合物Y能完全释放出
溶液中,混合物Y能完全释放出![]() 。
。![]()
![]() 完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出
完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出![]() 的物质的量为________。
的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下
![]()
下列说法不正确的是( )。
A.C12H22O11属于二糖B.1mol葡萄糖可分解成3mol乙醇
C.可用碘水检验淀粉是否完全水解D.不能用分液操作分离乙醇和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)NO2(g)△H=+57kJmol﹣1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )

A.A、C两点的反应速率:v(A)>v(C)
B.A、C两点气体的颜色:A深,C浅
C.B点正逆反应速率:v(正)>v(逆)
D.A、C两点气休的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液在图 1 装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)写出该反应的中和热热化学方程式:___________。
(2)___________(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒,其原因是_____。
(3)如果改用 60mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(“增加”、“减少”或“不变”),所求中和热数值_____(“增加”、“减少”或“不变”)。
(4)某研究小组将装置完善后,把 V1 mL 1.0mol/L HCl 溶液和 V2 mL 未知浓度的 NaOH 溶液混合均匀后测量并记录溶液温度,实验结果如图 2 所示(实验中始终保持 V1+V2 = 50mL)。回答下列问题:研究小组做该实验时环境温度_________(填“高于”、“低于”或“等于”)22℃。
(5)①请填写下表中的空白:
温度 实验次数 | 起始温度 t1℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 32.9 | ________________________ |
2 | 27.0 | 27.4 | 27.2 | 37.0 | |
3 | 25.9 | 25.9 | 25.9 | 32.5 | |
4 | 26.4 | 26.2 | 26.3 | 33.3 | |
②近似认为 50mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液的密度都是 1 g/cm3,中和后生成溶液的比热容 c=4.18 J/(g·℃)。则中和热Δ H=_________( 取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 c(H+)=0.01mol/L 的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种酸的物质的量浓度依次为 c1、c2、c3,则其关系是_____(用“>、<、=”表示,下同)。
(2)取同体积的三种酸溶液分别加入足量的锌粉,反应过程中放出 H2 的速率依次为 b1、b2、b3,则其关系是________________。
(3)完全中和体积和物质的量浓度均相同的三份 NaOH 溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
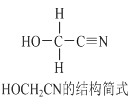
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是

① ② ③ ④
A. 装置①可用于证明SO2与NaOH溶液发生了反应
B. 若装置②中X为CCl4,可用于吸收氨气或氯化氢
C. 装置③可用于实验室从食盐水中提取氯化钠
D. 装置④可用于证明溴乙烷与NaOH乙醇溶液共热生成乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com