
【题目】50mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液在图 1 装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)写出该反应的中和热热化学方程式:___________。
(2)___________(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒,其原因是_____。
(3)如果改用 60mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(“增加”、“减少”或“不变”),所求中和热数值_____(“增加”、“减少”或“不变”)。
(4)某研究小组将装置完善后,把 V1 mL 1.0mol/L HCl 溶液和 V2 mL 未知浓度的 NaOH 溶液混合均匀后测量并记录溶液温度,实验结果如图 2 所示(实验中始终保持 V1+V2 = 50mL)。回答下列问题:研究小组做该实验时环境温度_________(填“高于”、“低于”或“等于”)22℃。
(5)①请填写下表中的空白:
温度 实验次数 | 起始温度 t1℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 32.9 | ________________________ |
2 | 27.0 | 27.4 | 27.2 | 37.0 | |
3 | 25.9 | 25.9 | 25.9 | 32.5 | |
4 | 26.4 | 26.2 | 26.3 | 33.3 | |
②近似认为 50mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液的密度都是 1 g/cm3,中和后生成溶液的比热容 c=4.18 J/(g·℃)。则中和热Δ H=_________( 取小数点后一位)。
【答案】NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol 不能 金属导热,导致热量散失 增加 不变 低于 6.8 -56.8 kJ/mol
【解析】
(1)中和热热化学方程式中要求H2O的生成量为1mol,所以热化学方程式为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)不能将环形玻璃搅拌棒改为环形铜棒,原因是铜棒是金属材质,导热性能好,造成热量散失,导致误差较大。
(3)改用 60mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液进行反应,盐酸过量,NaOH完全反应,所以所放热量增加;中和热对应生成1molH2O所产生的热值,所以所求中和热数值不变;
(4)由图2可知,当V1接近5mL时,反应已经发生,伴随放热,混合溶液温度接近22℃,所以该实验时环境温度小于22℃;
(5)4次平行试验的温差分别为:6.8℃、9.8℃、6.6℃、7℃,第二组试验偏差较大,无效,所以有效的为其他3组数据,可得平均温差为6.8℃;根据公式计算:
![]() ,Δ H=-56.8 kJ/mol
,Δ H=-56.8 kJ/mol


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加
B.设NA为阿伏加德罗常数的值,500mL1mol/L氯化铁溶液中Fe3+的数目等于0.5NA
C.常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12
D.要判断反应进行方向,须综合考虑体系的焓变和熵变,焓减且熵增的反应为自发反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.由C(石墨)=C(金刚石)ΔH=+11.9kJ/mol,可知金刚石比石墨稳定
C.我国目前使用的主要能源是化石燃料,属于不可再生能源
D.可表示氢气燃烧热的热化学方程式为H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个固定体积的密闭容器充入 2mol A 和 1mol B,发生如下反应:2A(g)+B(g) 3C(g)+D(g),2 分钟后,反应达到平衡,C 的浓度为 1.2mol/L。
(1)用 A 表示 2 分钟内平均反应速率为_____,A 在第 1 分钟平均速率_______第 2分钟平均速率(填“<”、“>”、“=”)。
(2)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为_____(填“吸热”或“放热”)反应.
(3)增大 B 的转化率,可采取的措施是_____(用序号填空)
①加入 A ②加入 B ③加压④再加入 1.6mol A+0.8mol B ⑤将 C 分离出容器
(4)若在相同条件下,在上述容器中充入 1.5mol C 和 0.5mol D 发生上述反应,为使平衡后,C 的浓度仍为 1.2mol/L,则应再充入_____molA 和_____molB.
(5)若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a 点改变的条件可能是_____;b 点改变的条件可能是_____;若升高温度时,请将反应速率变化情况画在 c-d 处。_____________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作无不当之处的是( )
A.用稀硫酸和锌粒制取![]() 时,加几滴
时,加几滴![]() 溶液以加快反应速率
溶液以加快反应速率
B.用蒸馏水润湿的pH试纸测某气体的酸碱性
C.淀粉水解实验中可加银氨溶液并水浴加热检验淀粉的水解产物葡萄糖
D.在50mL酸式滴定管中装入盐酸,调整初始读数为![]() 后,将剩余盐酸放入锥形瓶,可以量出
后,将剩余盐酸放入锥形瓶,可以量出![]() 的盐酸
的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AlH3。下列说法正确的是( )
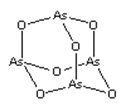
A.As2O3 分子中As原子的杂化方式为sp2
B.LiAlH4为共价化合物
C.AsCl3空间构型为平面正三角形
D.AlH3分子键角大于109.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是( )

A.1 mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56g Fe参加反应,共有NA个![]() 被还原
被还原
C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)为1×10-10mol·L-1
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com