
【题目】下列实验操作无不当之处的是( )
A.用稀硫酸和锌粒制取![]() 时,加几滴
时,加几滴![]() 溶液以加快反应速率
溶液以加快反应速率
B.用蒸馏水润湿的pH试纸测某气体的酸碱性
C.淀粉水解实验中可加银氨溶液并水浴加热检验淀粉的水解产物葡萄糖
D.在50mL酸式滴定管中装入盐酸,调整初始读数为![]() 后,将剩余盐酸放入锥形瓶,可以量出
后,将剩余盐酸放入锥形瓶,可以量出![]() 的盐酸
的盐酸
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(![]() )电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:

下列叙述错误的是( )
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有![]() 、
、![]() 、
、![]()
C.“沉淀”反应的金属离子为![]()
D.上述流程中可用硫酸钠代替碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下
![]()
下列说法不正确的是( )。
A.C12H22O11属于二糖B.1mol葡萄糖可分解成3mol乙醇
C.可用碘水检验淀粉是否完全水解D.不能用分液操作分离乙醇和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液在图 1 装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)写出该反应的中和热热化学方程式:___________。
(2)___________(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒,其原因是_____。
(3)如果改用 60mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(“增加”、“减少”或“不变”),所求中和热数值_____(“增加”、“减少”或“不变”)。
(4)某研究小组将装置完善后,把 V1 mL 1.0mol/L HCl 溶液和 V2 mL 未知浓度的 NaOH 溶液混合均匀后测量并记录溶液温度,实验结果如图 2 所示(实验中始终保持 V1+V2 = 50mL)。回答下列问题:研究小组做该实验时环境温度_________(填“高于”、“低于”或“等于”)22℃。
(5)①请填写下表中的空白:
温度 实验次数 | 起始温度 t1℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 32.9 | ________________________ |
2 | 27.0 | 27.4 | 27.2 | 37.0 | |
3 | 25.9 | 25.9 | 25.9 | 32.5 | |
4 | 26.4 | 26.2 | 26.3 | 33.3 | |
②近似认为 50mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液的密度都是 1 g/cm3,中和后生成溶液的比热容 c=4.18 J/(g·℃)。则中和热Δ H=_________( 取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 c(H+)=0.01mol/L 的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种酸的物质的量浓度依次为 c1、c2、c3,则其关系是_____(用“>、<、=”表示,下同)。
(2)取同体积的三种酸溶液分别加入足量的锌粉,反应过程中放出 H2 的速率依次为 b1、b2、b3,则其关系是________________。
(3)完全中和体积和物质的量浓度均相同的三份 NaOH 溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为基本原料可制备许多物质,如:

下列有关说法中正确的是
A.淀粉是糖类物质,有甜味,与纤维素互为同分异构体
B.反应③是消去反应,反应④是加聚反应,反应⑤是氧化反应
C.乙烯、聚乙烯分子中均含有碳碳双键,均可被酸性KMnO4溶液氧化
D.反应②是葡萄糖发生水解生成了CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
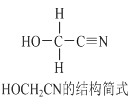
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是______________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是__________。
(3)Cu2Cl22CO2H2O是一种配合物,其结构如图所示:
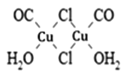
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
(4)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。
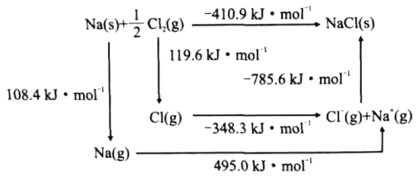
a、Cl-Cl键的键能为119.6kJ/mol b、Na的第一电离能为603.4kJ/mol
c、NaCl的晶格能为785.6kJ/mol d、Cl的第一电子亲和能为348.3kJ/mol
(5)碲化锌晶体有两种结构,其中一种晶胞结构如图:
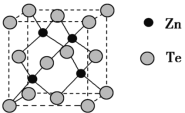
若与Zn距离最近的Te原子间距为a pm,则晶体密度为__________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的锌与100mL![]() 浓硫酸充分反应后,锌完全溶解,同时生成气体A
浓硫酸充分反应后,锌完全溶解,同时生成气体A![]() 标准状况
标准状况![]() 将反应后的溶液稀释至1L,测得溶液的
将反应后的溶液稀释至1L,测得溶液的![]() ,则下列叙述中错误的是
,则下列叙述中错误的是![]()
A.气体A为![]() 和
和![]() 的混合物
的混合物
B.反应中共消耗![]()
C.气体A中![]() 和
和![]() 的体积比为4:1
的体积比为4:1
D.反应中共转移3mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com