
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是______________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是__________。
(3)Cu2Cl22CO2H2O是一种配合物,其结构如图所示:
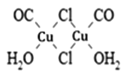
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
(4)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。
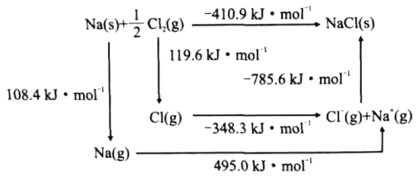
a、Cl-Cl键的键能为119.6kJ/mol b、Na的第一电离能为603.4kJ/mol
c、NaCl的晶格能为785.6kJ/mol d、Cl的第一电子亲和能为348.3kJ/mol
(5)碲化锌晶体有两种结构,其中一种晶胞结构如图:
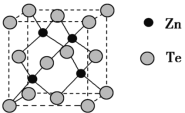
若与Zn距离最近的Te原子间距为a pm,则晶体密度为__________g/cm3。
【答案】第四周期Ⅷ Co失去的是3d6上的一个电子,而Fe失去的是半充满状态3d5上的一个电子,故Fe需要的能量较高 sp3 电负性C<O,C对孤电子对的吸引力较弱,更容易给出孤电子对 cd 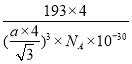
【解析】
根据原子的电子层数及其价电子数确定元素在周期表中的位置。根据原子及其离子的价电子排布分析其电离能的相对大小。根据价层电子对互斥理论分析原子的杂化类型。根据电负性的大小分析配合物中的配位原子。分析表中数据并结合相关概念判断有关变化中能量变化。根据晶胞结构分析晶体的化学式并进行相关计算。
(1)钴是27号元素,其有4个电子层,其价电子排布式为3d74s2,因此,其在周期表中的位置是第四周期Ⅷ族。
(2)Fe的价电子排布式为3d64s2,其失去3个电子后变为较稳定的半充满结构3d5,而Co的价电子排布式为3d74s2,其失去3个电子后变为3d6。因此,从原子结构的角度分析I4(Fe)> I4 (Co)的可能原因是:Co失去的是3d6上的一个电子,而Fe失去的是半充满状态3d5上的一个电子,故Fe需要的能量较高。
(3)由Cu2Cl22CO2H2O的结构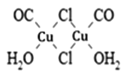 可知:
可知:
①该配合物中氯原子均形成2个σ键,另外每个氯原子还有2个孤电子对,故其价层电子对数为4,其杂化方式为sp3。
②CO分子中的C原子和O原子均有孤电子对,但是O元素的电负性大于C元素,故O原子对孤电子对的吸引力更强,因此,该配合物中,CO作配体时配位原子是C而不是O的原因是:电负性C<O,C对孤电子对的吸引力较弱,更容易给出孤电子对(用于形成配位键)。
(4)a、由图中信息可知,![]() Cl2(g)=Cl(g)的H=119.6kJ/mol,因此, Cl-Cl键的键能为239.2kJ/mol ,a不正确;
Cl2(g)=Cl(g)的H=119.6kJ/mol,因此, Cl-Cl键的键能为239.2kJ/mol ,a不正确;
b、由图中信息可知,Na(g)=Na+(g)+e-的H=495.0kJ/mol,因此, Na的第一电离能为603.4kJ/mol,b不正确;
c、由图中信息可知,Cl-(g)+ Na+(g)= NaCl(s)的H= -785kJ/mol,因此,NaCl的晶格能为785.6kJ/mol,c正确;
d、由图中信息可知,Cl(g) +e-=Cl-(g) 的H= -348.3kJ/mol,因此,Cl的第一电子亲和能为348.3kJ/mol,d正确。
综上所述,有关说法正确的是cd。
(5)由碲化锌晶体的晶胞结构示意图可知,其晶胞结构与金刚石相似,Te原子堆积方式为面心立方最密堆积,Zn距离最近的Te原子间距为体对角线长度的![]() ,高晶胞参数(即该晶胞的边长)为x,则晶胞的体对角线长度为,
,高晶胞参数(即该晶胞的边长)为x,则晶胞的体对角线长度为,![]() x=4a pm,故x=
x=4a pm,故x=![]() pm,晶胞的体积为x3=
pm,晶胞的体积为x3=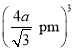 。该晶胞中占有4个Te原子和4个Zn原子,则晶胞的质量为
。该晶胞中占有4个Te原子和4个Zn原子,则晶胞的质量为![]() 。因此,该晶体密度为
。因此,该晶体密度为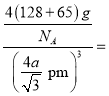
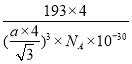 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】下列实验操作无不当之处的是( )
A.用稀硫酸和锌粒制取![]() 时,加几滴
时,加几滴![]() 溶液以加快反应速率
溶液以加快反应速率
B.用蒸馏水润湿的pH试纸测某气体的酸碱性
C.淀粉水解实验中可加银氨溶液并水浴加热检验淀粉的水解产物葡萄糖
D.在50mL酸式滴定管中装入盐酸,调整初始读数为![]() 后,将剩余盐酸放入锥形瓶,可以量出
后,将剩余盐酸放入锥形瓶,可以量出![]() 的盐酸
的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AlH3。下列说法正确的是( )
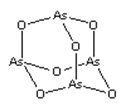
A.As2O3 分子中As原子的杂化方式为sp2
B.LiAlH4为共价化合物
C.AsCl3空间构型为平面正三角形
D.AlH3分子键角大于109.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种广泛用于锂离子电池的物质结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期主族元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是

A.X的氢化物中只有极性键
B.Y在该物质中有两种不同价态
C.Z的单质能与水反应生成Y的单质
D.简单离子的还原性W<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
(1)该融雪剂的化学式______________;X与氢元素形成的化合物的电子式_____________。
(2)元素D、E原子的最外层电子数均为电子层数的2倍,D与Y相邻,则D离子的原子结构示意图是____________ ;D与E能形成一种非极性分子,该分子的结构式____________;写出与其互为等电子体的一种分子和阴离子________________、___________________。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是____________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,写出该反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( )

A. 对于曲线I,在b点加热,b点向c点移动
B. 常温下NiCO3的溶解度大于NiS的溶解度
C. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
D. P为3.5且对应的阴离子是CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是( )

A.1 mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56g Fe参加反应,共有NA个![]() 被还原
被还原
C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)为1×10-10mol·L-1
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得浓度均为0.5 molL-1的Pb(CH3COO)2溶液的导电性明显弱于Pb(NO3)2溶液,又知PbS是不溶于水及稀酸的黑色沉淀,下列离子方程式书写错误的是
A.Pb(NO3)2溶液与 CH3COONa 溶液混合:Pb2++2CH3COO-= Pb(CH3COO)2
B.Pb(NO3)2 溶液与K2S溶液混合:Pb2++S2-=PbS↓
C.Pb(CH3COO)2 溶液与K2S溶液混合:Pb2++S2- =PbS↓
D.Pb(CH3COO)2 在水中电离: Pb(CH3COO)2![]() Pb2+ +2CH3COO-
Pb2+ +2CH3COO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com