
【题目】一种广泛用于锂离子电池的物质结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期主族元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是

A.X的氢化物中只有极性键
B.Y在该物质中有两种不同价态
C.Z的单质能与水反应生成Y的单质
D.简单离子的还原性W<Y
【答案】C
【解析】
根据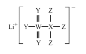 此结构可知,X共用4对电子,W共用6对电子,Y共用2对电子,Z共用1对电子,因为Y和W同主族,所以为ⅥA族,根据原子序数大小关系,Y为O元素,W为S元素;因为原子半径r(X)>r(Y)>r(Z),则X、Y、Z同周期,X为C元素;Z为F元素;据此分析。
此结构可知,X共用4对电子,W共用6对电子,Y共用2对电子,Z共用1对电子,因为Y和W同主族,所以为ⅥA族,根据原子序数大小关系,Y为O元素,W为S元素;因为原子半径r(X)>r(Y)>r(Z),则X、Y、Z同周期,X为C元素;Z为F元素;据此分析。
A.X为C元素,C的氢化物可以是甲烷、乙烷、丙烷等,有极性键,也可能含有非极性键,A错误;
B.该物质为LiSO3CF3,O元素的化合价为-2价,B错误;
C.Z为F元素,Y为O元素,2F2+2H2O=4HF+O2,C正确;
D.Y为O元素,W为S元素;S的还原性大于O,则S2-的还原性大于O2-,D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】目前,我国使用的能源主要是煤、石油、天然气等,这些能源都是不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。科学家预测氢能将是21世纪最理想的新能源之一。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较经济且资源可持续利用的制氢气的方法是________(填序号)。
A.电解水 B.锌和稀硫酸反应 C.光解海水
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:![]()
![]()
![]()
![]()
由甲烷制氢气的一个缺点是________。
(3)将![]() 进行热分解也可以制得氢气
进行热分解也可以制得氢气![]()
![]() 。热分解制氢气时,常向反应器中通入一定比例的空气,使部分
。热分解制氢气时,常向反应器中通入一定比例的空气,使部分![]() 燃烧,其目的是_________________________。
燃烧,其目的是_________________________。
(4)镁铝合金(![]() )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的![]() 、
、![]() 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为![]() 得到的混合物
得到的混合物![]() 在一定条件下可释放出氢气。
在一定条件下可释放出氢气。
①熔炼制备镁铝合金(![]() )时通入氩气的目的是____________________________________。
)时通入氩气的目的是____________________________________。
②在足量的![]() 的
的![]() 溶液中,混合物Y能完全释放出
溶液中,混合物Y能完全释放出![]() 。
。![]()
![]() 完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出
完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出![]() 的物质的量为________。
的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 c(H+)=0.01mol/L 的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种酸的物质的量浓度依次为 c1、c2、c3,则其关系是_____(用“>、<、=”表示,下同)。
(2)取同体积的三种酸溶液分别加入足量的锌粉,反应过程中放出 H2 的速率依次为 b1、b2、b3,则其关系是________________。
(3)完全中和体积和物质的量浓度均相同的三份 NaOH 溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
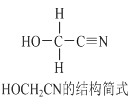
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学学完![]() 化学
化学![]() 的知识后得出下列结论,其中正确的是( )
的知识后得出下列结论,其中正确的是( )
A.将NaH溶于水,得到的水溶液能导电,由此可说明NaH是离子化合物
B.![]() 胶体和
胶体和![]() 沉淀的物理性质不同但化学性质基本相同
沉淀的物理性质不同但化学性质基本相同
C.![]() 、
、![]() 、
、![]() 、
、![]() 等都是酸性氧化物;
等都是酸性氧化物;![]() 、MgO、
、MgO、![]() 等都是碱性氧化物
等都是碱性氧化物
D.![]() 具有较强氧化性,可作为
具有较强氧化性,可作为![]() 分解反应的氧化剂
分解反应的氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是______________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是__________。
(3)Cu2Cl22CO2H2O是一种配合物,其结构如图所示:
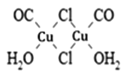
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
(4)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。
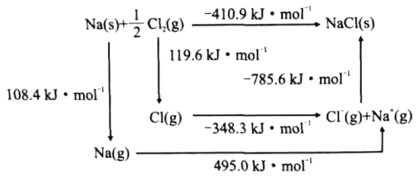
a、Cl-Cl键的键能为119.6kJ/mol b、Na的第一电离能为603.4kJ/mol
c、NaCl的晶格能为785.6kJ/mol d、Cl的第一电子亲和能为348.3kJ/mol
(5)碲化锌晶体有两种结构,其中一种晶胞结构如图:
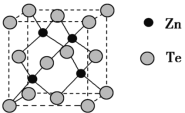
若与Zn距离最近的Te原子间距为a pm,则晶体密度为__________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究乙醇的结构及化学性质,进行下列实验。试回答下列问题:
Ⅰ.用如图所示装置来推测乙醇的结构式。

(1)实验中钠需要粉碎成很小的颗粒,其原因是___。
(2)两次实验平均均用乙醇1.15g,收集到气体的体积平均为0.28L(标准状况下)。上实验数据可以推测乙醇分子的结构,依据是___。
Ⅱ.利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。(夹持装置已略去)

(3)装置A圆底瓶内的固体物质是___,C中热水的作用是___。
(4)实验过程中D装置可以观察到的实验现象为___,写出D处发生反应的化学方程式:___。
(5)检验E中的生成物的方法为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是

① ② ③ ④
A. 装置①可用于证明SO2与NaOH溶液发生了反应
B. 若装置②中X为CCl4,可用于吸收氨气或氯化氢
C. 装置③可用于实验室从食盐水中提取氯化钠
D. 装置④可用于证明溴乙烷与NaOH乙醇溶液共热生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClNO(名称:亚硝酰氯,熔点﹣64.5℃,沸点:﹣5.5℃)是有机物合成中的重要试剂,为红褐色液体或黄色气体,与水发生反应:2ClNO+H2O=NO+NO2+2HCl,某学习小组在实验室用Cl2和NO按如图装置制备ClNO,并测定其纯度。请回答问题:
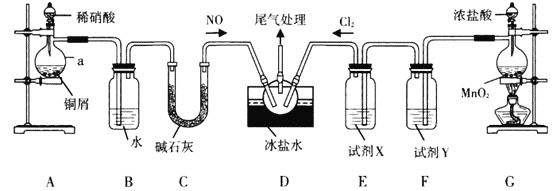
(1)仪器a的名称是___;a中反应的离子方程式为___。
(2)试剂X、Y依次为___、____;冰盐水的作用是的作用是___。
(3)实验时,现在三颈烧瓶内通入Cl2,待其中充满黄绿色气体时,再通入NO,这样做的目的是__。
(4)从三颈烧瓶溢出的尾气不能直接通入NaOH溶液中,原因是___。
(5)ClNO与NaOH溶液发生的化学方程式为___。(已知:NO+NO2+2NaOH=2NaNO2+H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com