
【题目】ClNO(名称:亚硝酰氯,熔点﹣64.5℃,沸点:﹣5.5℃)是有机物合成中的重要试剂,为红褐色液体或黄色气体,与水发生反应:2ClNO+H2O=NO+NO2+2HCl,某学习小组在实验室用Cl2和NO按如图装置制备ClNO,并测定其纯度。请回答问题:
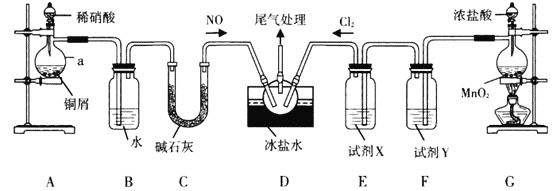
(1)仪器a的名称是___;a中反应的离子方程式为___。
(2)试剂X、Y依次为___、____;冰盐水的作用是的作用是___。
(3)实验时,现在三颈烧瓶内通入Cl2,待其中充满黄绿色气体时,再通入NO,这样做的目的是__。
(4)从三颈烧瓶溢出的尾气不能直接通入NaOH溶液中,原因是___。
(5)ClNO与NaOH溶液发生的化学方程式为___。(已知:NO+NO2+2NaOH=2NaNO2+H2O)
【答案】蒸馏烧瓶 3Cu+8H++2![]() =3Cu2++2NO↑+4H2O 浓硫酸 饱和食盐水 冷凝ClNO,防止挥发 排尽装置中的空气,防止NO被氧化 NaOH溶液中水蒸汽进入三颈烧瓶会与ClNO反应,导致产品不纯,且容易引起倒吸 2ClNO+4NaOH=2NaNO2+2NaCl+2H2O
=3Cu2++2NO↑+4H2O 浓硫酸 饱和食盐水 冷凝ClNO,防止挥发 排尽装置中的空气,防止NO被氧化 NaOH溶液中水蒸汽进入三颈烧瓶会与ClNO反应,导致产品不纯,且容易引起倒吸 2ClNO+4NaOH=2NaNO2+2NaCl+2H2O
【解析】
A装置制取NO,因为硝酸具有挥发性导致生成的NO中含有硝酸,硝酸易溶于水,NO不溶于水,用B装置除去硝酸,C装置干燥NO,G装置制取氯气,因为浓盐酸具有挥发性,所以生成的氯气中含有HCl,且还含有水蒸气,用F中的饱和食盐水除去HCl,用E装置中浓硫酸干燥氯气,NO和氯气加入D装置发生反应生成ClNO,据此解答。
(1)仪器a的名称是蒸馏烧瓶,a中Cu和稀硝酸反应生成硝酸铜、NO和水,离子方程式为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,故答案为:蒸馏烧瓶;3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O;
(2)试剂X除去水蒸气,Y除去HCl,浓硫酸除去水蒸气、饱和食盐水除去HCl,所以X是浓硫酸、Y是饱和食盐水,亚硝酰氯,熔点﹣64.5℃,沸点:﹣5.5℃,易挥发,所以冰盐水的作用是冷凝ClNO,防止挥发,故答案为:浓硫酸;饱和食盐水;冷凝ClNO,防止挥发;
(3)NO易被空气中的氧气氧化生成二氧化氮,为防止装置中氧气氧化NO,所以先通入氯气排除空气,故答案为:排尽装置中的空气,防止NO被氧化;
(4)一方面,从三颈烧瓶溢出的尾气直接通入NaOH溶液中会引起倒吸,另一方面,根据已知信息:亚硝酰氯(ClNO)与水反应生成二氧化氮、氯化氢和一氧化氮,而且二氧化氮、NO能与NaOH反应生NaNO2,导致产品不纯,所以尾气不能直接通入NaOH溶液中,故答案为:NaOH溶液中水蒸汽进入三颈烧瓶会与ClNO反应,导致产品不纯,且容易引起倒吸;
(5)2ClNO+H2O=NO+NO2+2HCl,HCl和NaOH反应生成氯化钠和水,NO+NO2+2NaOH=2NaNO2+H2O,所以ClNO和NaOH溶液反应方程式为2ClNO+4NaOH=2NaNO2+2NaCl+2H2O,故答案为:2ClNO+4NaOH=2NaNO2+2NaCl+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种广泛用于锂离子电池的物质结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期主族元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是

A.X的氢化物中只有极性键
B.Y在该物质中有两种不同价态
C.Z的单质能与水反应生成Y的单质
D.简单离子的还原性W<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
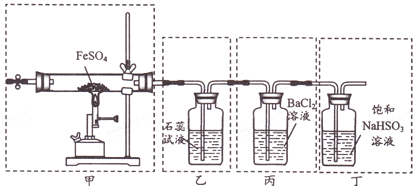
A. 用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B. 用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色
C. 用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D. 用装置丁可吸收尾气,避免污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下用途与其含有的碳碳不饱和键(![]() )有关的是
)有关的是
A. 衣服上的油脂可用汽油洗去
B. 适量摄入油脂,有利于人体吸收多种脂溶性维生素和胡萝卜素
C. 植物油通过氢化可以制造植物奶油(人造奶油)
D. 脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得浓度均为0.5 molL-1的Pb(CH3COO)2溶液的导电性明显弱于Pb(NO3)2溶液,又知PbS是不溶于水及稀酸的黑色沉淀,下列离子方程式书写错误的是
A.Pb(NO3)2溶液与 CH3COONa 溶液混合:Pb2++2CH3COO-= Pb(CH3COO)2
B.Pb(NO3)2 溶液与K2S溶液混合:Pb2++S2-=PbS↓
C.Pb(CH3COO)2 溶液与K2S溶液混合:Pb2++S2- =PbS↓
D.Pb(CH3COO)2 在水中电离: Pb(CH3COO)2![]() Pb2+ +2CH3COO-
Pb2+ +2CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】x mol的铁铝合金完全溶于1L某稀硝酸后,生成了y mol的NO(无其他还原产物).则关于该反应的下列说法中,不正确的是( )
A.在该反应中,硝酸既显氧化性,又显酸性
B.根据题中所给条件,无法计算出硝酸的物质的量浓度
C.参加反应的硝酸的物质的量为4y mol
D.若将生成的NO与O2混合溶于水被完全吸收,需标准状况下O2的体积是11.2y L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),在一个可变容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g),在一个可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其反应速率的变化是___(填“增大”“不变”或“减小”)。
(2)增加H2O的量,其反应速率__(填“增大”“不变”或“减小”)。
(3)将容器的体积缩小一半,其反应速率__(填“增大”“不变”或“减小”)。
(4)保持体积不变,充入N2使体系压强增大,其反应速率___。(填“增大”“不变”或“减小”)。
(5)保持压强不变,充入N2使容器的体积增大,其反应速率___(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究Mg与NaHCO3溶液反应的机理,做了如下探究。
实验一:
实验A | 实验B | |
操作 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL饱和NaHCO3溶液。 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL蒸馏水。 |
现象 | 有气体产生,20min后注射器内壁和底部产生大量白色沉淀 | 缓慢产生气体 |
(1)实验B的目的是___。
实验二:
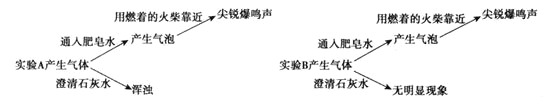
(2)根据实验二,实验A中产生的气体是___。(填分子式)
实验三:分别取少量实验A和B的上层清液于两支试管中,各加入2滴BaCl2溶液,A中立即产生白色沉淀,B中无明显现象。
(3)实验三说明Mg与NaHCO3溶液反应产生了___(填离子符号)。
实验四:该小组同学对实验A中产生的白色沉淀做出如下猜测:并用图所示装置进行实验,进一步确定白色沉淀的成分。

猜测1:白色不溶物可能为Mg(OH)2
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2xMgCO3]
(4)若用装置A、B组合进行实验,B中有白色浑浊,则猜想___不正确;将装置按A、C、B的顺序组合进行实验,当出现___现象时,猜想3是正确的。
实验五:用图所示装置测定碱式碳酸镁[yMg(OH)2xMgCO3]的组成:
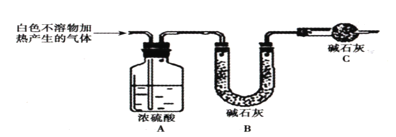
(5)称取干燥、纯净的白色不溶物7.36g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64g。装置C的作用是___,白色不溶物的化学式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com