
【题目】下列各选项对应关系错误的是
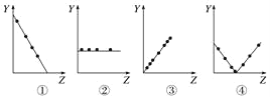
A.图①可以表示F-、Na+、Mg2+、Al3+四种半径的大小关系
B.图②可以表示ⅡA族元素原子的最外层电子数
C.图③可以表示第三周期各主族元素的最高化合价
D.图④可以表示第三周期中各主族元素的最高化合价与最低化合价之和
科目:高中化学 来源: 题型:
【题目】某晶体的晶胞结构为正三棱柱(如图所示),这种晶体中A、B、C三种微粒数目之比为( )

A. 1∶4∶2 B. 3∶9∶4
C. 2∶9∶4 D. 3∶8∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X为中学化学常见物质,A、B、C含有相同元素甲,可以发生如下转化(水参与的反应,水未标出)。
![]()
下列说法不正确的是
A.若A、B、C的焰色反应呈黄色、水溶液均呈碱性,则X可以是CO2
B.若C为红棕色气体,则A一定为空气中含量最高的气体
C.若B为FeCl3,则X一定是Fe
D.A可以是碳单质,也可以是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为19。Y原子的电子层数与最外层电子数的比等于1/3,Z原子最外层电子数与内层电子数的比为1:10。下列说法正确的是
A. 非金属性:Y<X<W
B. 简单气态氢化物的热稳定性:Y<X
C. 化合物ZW、XY中化学键类型相同
D. X、W的最高价氧化物的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于以下反应:A(s)+3B(g)![]() 2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
A.容器的体积不再发生变化
B.B的生成速率和D的反应速率之比为3∶1
C.混合气体的密度不随时间变化
D.B、C、D的分子个数之比为3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铬废水中铬的存在形式有三价铬和六价铬两种,其中以六价铬的毒性最大。工业常用还原沉淀法处理含Cr2O72-和CrO42-的废水,其工艺流程如下:
![]()
下列叙述不正确的是
A.“转化”过程中溶液由橙色变为黄色
B.“还原”反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
C.在酸性条件下,用铁板作阳极电解含铬废水也可以将Cr2O72-还原为Cr3+
D.还原沉淀法产生的污泥是混合污泥不利于回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。一种锂离子电池充电时的阳极反应式为:LiFePO4-xe-=xFePO4+(1-x)LiFePO4+xLi+,放电时的工作原理如图。下列叙述不正确的是
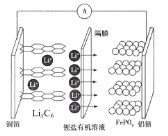
A.该电池工作时Fe、P元素化合价均不变
B.放电时,电子由铜箔经外电路流向铝箔
C.充电时,铝箔电极应该接电源的正极
D.充电时,Li+通过隔膜移向铜箔电极方向迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物) 为原料制备Mg CO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为:
MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O H = -50.4kJ·mol-1
Mg2SiO4(s) +4 H+(aq)=2 Mg2+(aq) +H2SiO3(s) + H2O(l) H =-225.4kJ··mol-1
向Mg2SiO4悬浊液中通入CO2析出H2SiO3的热化学方程式为__________,该反应能正向进行的热力学原因是_________。该反应的平衡常数表达式为__________。
(2)对氧化后的溶液,加入萃取剂磷酸二异辛酯(C16H35O4P)的煤油溶液,并调节pH为1.4~4.3,萃取剂的体积约为水溶液的0.5倍,充分振荡、静止、分层(上层为含三价铁的有机层),分液。向分液得到的有机层加硫酸反萃取得到硫酸铁溶液,从而与有机层分离。萃取反应为:Fe2(SO4)3(水层)+6HA(有机层)=2FeA3(有机层)+3H2SO4(水层)
①提高萃取效率的措施有__________。
A 适当提高萃取剂的浓度 B 适当提高溶液酸度
C 充分振荡,多次萃取 D 不断地从下层排除出有机层
②在反萃取中加硫酸的作用是___________。
(3)萃取后的水溶液制备Mg CO3·3H2O的实验方案:滴加氨水调节溶液的pH在一定范围内,过滤。向滤液中滴加Na2 CO3溶液,搅拌、静置、过滤,用水洗涤固体2~3次,在50℃下干燥,得到Mg CO3·3H2O。[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
①调节溶液pH的范围____________。
②判断向滤液中滴加Na2CO3溶液过量的方法__________。
(4)从废渣制备Mg CO3·3H2O的整体实验方案看,酸溶时所加H2SO4不宜过量太多的原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com