
【题目】化合物X由三种元素(其中一种是第四周期元素)组成,现进行如下实验:

已知:气体A在标准状况下密度为0.714 g·L-1;碱性溶液焰色反应呈黄色。
(1)X中非金属元素的名称为__________,X的化学式__________。
(2)X与水反应的化学方程式为_________。
(3)化合物Y由X中金属元素和第四周期元素构成,设计实验证明Y的晶体类型__________。
(4)补充焰色反应的操作:取一根铂丝,________,蘸取待测液灼烧,观察火焰颜色。
【答案】碳、溴 Na5CBr Na5CBr+4H2O=4NaOH+NaBr+CH4↑ 将Y加热至熔化,然后测其导电性,若熔融状态下能导电,证明该物质是由离子构成的离子晶体 放在稀盐酸中洗涤后在酒精灯火焰上灼烧至无色
【解析】
X与水反应产生气体A和碱性溶液,气体A摩尔质量为M=0.714 g·L-1×22.4 L/mol=16 g/mol,则A是CH4,说明X中含有C元素;碱性溶液焰色反应呈黄色,说明碱性溶液含有钠元素,物质X中有钠元素;向该碱性溶液中加入0.04 mol HCl溶液显中性后,再加入足量HNO3酸化,再加入AgNO3溶液产生两种沉淀,质量和为7.62 g,根据Cl-守恒,其中含有AgCl沉淀质量为m(AgCl)=0.04 mol×143.5 g/mol=5.74 g,X中含有的另外一种元素位于第四周期,可以与Ag+反应产生沉淀,则该元素为溴元素,则X的组成元素为Na、C、Br三种元素,形成的沉淀为AgBr,其质量为m(AgBr)= 7.62 g-5.74 g=1.88 g,n(AgBr)=1.88 g ÷188 g/mol=0.01 mol,X中含有Br-0.01 mol,其质量为0.01 mol×80 g/mol=0.80 g,结合碱性溶液中加入0.04 mol HCl,溶液显中性,说明2.07gX中含有0.05 molNa+,X与水反应产生0.01 mol HBr和0.05 mol NaOH,其中0.01 mol HBr 反应消耗0.01 mol NaOH,产生0.01 mol NaBr,还有过量0.04 molNaOH,则X中含有C的物质的量为n(C)=(2.07 g-0.05 mol×23 g/mol-0.80 g)÷12 g/mol=0.01 mol,n(Na):n(Br):n(C)=0.05:0.01:0.01=5:1:1,则X化学式为Na5CBr,Na5CBr与水反应总方程式为:Na5CBr+4H2O=4NaOH+NaBr+CH4↑,据此分析解答。
根据上述分析可知X是Na5CBr,A是CH4,碱性溶液为NaOH与NaBr按4:1混合得到的混合物,中性溶液为NaCl、NaBr按4:1物质的量的比的混合物,沉淀为AgCl、AgBr混合物,二者物质的量的比为4:1;
(1)X化学式为Na5CBr,其中非金属元素的名称为碳、溴;
(2)X与水反应的化学方程式为Na5CBr+4H2O=4NaOH+NaBr+CH4↑;
(3)化合物Y由X中金属元素和第四周期元素构成,则Y为NaBr,该化合物为离子化合物,证明Y的晶体类型实验是:将NaBr加热至熔化,测其导电性,若熔融状态下能导电,证明在熔融状态中含有自由移动的离子,则该物质是由离子构成的离子化合物;
(4)补充焰色反应的操作:取一根铂丝,放在稀盐酸中洗涤后在酒精灯或酒精喷灯火焰上灼烧至无色,然后蘸取待测液灼烧,观察火焰颜色,来确定其中含有的金属元素。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对乙烯和聚乙烯的描述中,不正确的是( )
A.乙烯是纯净物,聚乙烯是混合物
B.常温下,乙烯为气态,聚乙烯为固态
C.乙烯的化学性质与聚乙烯相同
D.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然油脂A的分子式为C37H106O6,1mol该油脂水解可得到1molB、2mol一元直链饱和脂肪酸C和1mol一元不饱和脂肪酸D,且C、D分子中碳原子数相同。以A为原料,通过下图的一系列转化关系,可以得到生物柴油G和高分子化合物M.
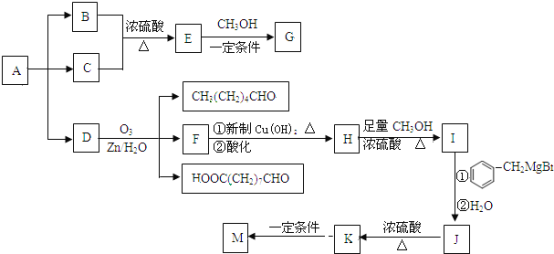
已知:1、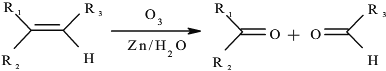
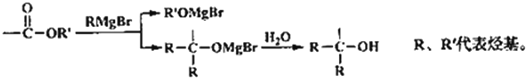
试回答下列问题:
(1)用系统命名法给D命名为_______________________;
(2)C的结构简式为______________________;
(3)下列有关生物柴油G的说法正确的是_________;
a.生物柴油G的主要成分属于烃类
b.生物柴油和石化柴油相比含硫量低,具有优良的环保特性
c.生物柴油是一种可再生能源,其资源不会像石油、煤炭那样会枯竭
d.由于提炼生物柴油的原料可以用地沟油,所以生产生物柴油的成本低,我国已经大面积使用生物柴油来代替矿物油,彻底解决了能源危机问题
(4)上述框图所示的下列物质的转化中,属于消去反应的是__________;
a、E→G b、D→F c、F→H d、I→J e、J→K F、K→M
(5)写出F→H的转化中,第一步反应的化学方程式__________________________;
(6)写出I→J的转化中,第一步反应的化学方程式__________________________;
(7)有机物J的一氯取代物(不考虑取代羟基上的氢,不考虑立体异构)有_________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室产生的废液中的阳离子只可能含有Na+、NH4+、Ba2+、Cu2+、Al3+、Fe2+、Fe3+中的某几种,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。
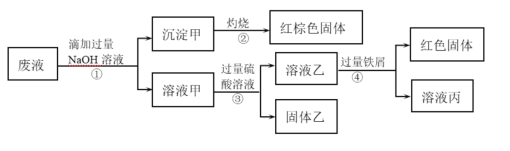
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是
A.根据步骤①的现象,说明废液中一定含有Al3+
B.由步骤②中红棕色固体可知,废液中一定存在Fe3+
C.沉淀甲中可能含有Al(OH)3
D.该废液中一定含有NH4+、Ba2+、Cu2+、Fe2+和Fe3+至少存在一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在生产和生活中有重要意义。海水中CO2的吸收能力取决于溶解的碳酸盐和硼酸盐生成的CO32-和B(OH)4-浓度。已知:298K时,H3BO3+H2O![]() H++B(OH)4-,Ka=5.7×10-10,碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
H++B(OH)4-,Ka=5.7×10-10,碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
(1)298K时,相同浓度的碳酸钠溶液和硼酸钠溶液,pH较大的是_______溶液。
(2)少量CO2与B(OH)4-反应的离子方程式为___________。
(3)采用高温熔融混合碳酸盐LiaNabKcCO3作电解质吸收并电解CO2制得无定型炭是CO2 资源化利用的一种新途径。此法的阴极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去)。则下列有关物质的推断不正确的是( )
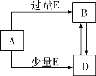
A.若A为碳,则E可能为氧气
B.若A为Na2CO3,则E可能为稀HCl
C.若A为Fe,E为稀HNO3,则D为Fe(NO3)3
D.若A为AlCl3,则D可能为Al(OH)3,E不可能为氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2=Fe3++2H2O
C.Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
D.向含 0.5 mol的FeBr2溶液中通入13.44L(标准状况下)Cl2:10Fe2++14Br-+12Cl2=10Fe3++7Br2+24Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子总数与X、W原子的电子总数之比为5:4。下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com