
【题目】将一定量的Cl2通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO3-物质的量0.03mol,请按要求完成下列问题
(1)该反应的离子方程式为___________________________________________。
(2)该反应中,氧化剂与还原剂物质的量之比为____________________。
(3)上述反应中,通入Cl2的物质的量为________mol,氢氧化钾溶液的物质的量浓度为________mol/L。
【答案】 5Cl2 + 10OH- = 7Cl- + 2ClO- + ClO3-+5H2O 7:3 0.15 7.5
【解析】(1)根据题给信息,氯气与KOH溶液反应生成氯化钾、氯酸钾、次氯酸钾和水,根据得失电子守恒,生成的n(Cl-)=0.06×1+0.03×5=0.21mol,反应中n(Cl-):n(ClO-):n(ClO3-)=0.21:0.06:0.03=7:2:1,再根据原子守恒配平其它物质的系数,反应的离子方程式为5Cl2 + 10OH- = 7Cl- + 2ClO- + ClO3-+5H2O;(2)根据上述离子反应,氯气既做氧化剂,又做还原剂,氧化剂与还原剂物质的量之比为7:(2+1)=7:3;(3)根据氯原子守恒,由反应5Cl2 + 10OH- = 7Cl- + 2ClO- + ClO3-+5H2O可知,通入Cl2的物质的量为![]() ;加入的KOH的物质的量为
;加入的KOH的物质的量为![]() ,物质的量浓度为
,物质的量浓度为![]() 。
。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】下列物质中不能用化合反应的方法制得的是( )
①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3⑤FeCl2 ⑥CaSiO3 .
A.①③
B.②④
C.②③④⑤
D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类不正确的是
A. 烧碱、纯碱、熟石灰都属于碱 B. H2SO4、HClO、H2CO3都属于酸
C. CuO、Na2O2和干冰都属于氧化物 D. NaHCO3、CuSO4·5H2O和KMnO4都属于盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中〔已知NaAlO2与CO2反应生成Al(OH)3〕,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2( g )+O2( g )=2H2O ( l )△H=﹣571.6kJ/mol 2H2( g )+O2( g )=2H2O ( g )△H=﹣483.6kJ/mol
CH4 ( g )+2O2( g )=2H2O ( l )+CO2( g )△H=﹣890kJ/mol
常温下,取甲烷和氢气的混合气体33.6L(标准状况下)经完全燃烧后恢复到常温,则放出的热量为730.8kJ,试求混合气体中甲烷和氢气体积比.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值.
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离.
①写出硫酸溶液与Fe2O3反应的离子方程式 .
②初步分离得到的滤渣主要成分是 .
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 结合表分析其原因 .
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验.
①氨水使滤液中铝离子沉淀的离子方程式为 .
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是 . 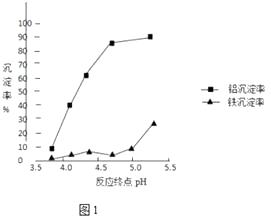
(4)Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3 .
已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
依据资料可知,将硫酸铝铵与其他溶质分离的方法是 .
(5)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种典型的强氧化剂。完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O (未配平)
② MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O (未配平)
(1)下列关于反应①的说法中错误的是_________(选填编号)。
a.被氧化的元素是Cu和S b.氧化剂与还原剂的物质的量之比为8:5
c.还原性的强弱关系是: Mn2+<Cu2S d.每生成2.24 L(标况) SO2,转移0.6mol电子
(2)配平并标出反应②中电子转移的方向和数目:_____
MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O
(3)若将H2O2加入KMnO4有反应:2KMnO4+7H2O2+3H2SO4= K2SO4+2MnSO4+6O2↑+10H2O,则被1molKMnO4氧化的H2O2是_________mol。
II.已知在碱性条件下:MnO4-+e-—→MnO42- (绿色)
(4) 将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,并且有气泡生成,写出反应的离子方程式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com