
����Ŀ����ú�ң���Ҫ����SiO2��Fe2O3��Al2O3�ȣ���ȼú��������в����ķ�������ú�ҵ��ۺ����þ��кܴ�ļ�ֵ��
���о���Աͨ��ʵ��Է�ú����������Ԫ�صķ��빤�ս������о���
��1����������Һ�ֽ��ú�ң�ʹ���е�������Ԫ���ܳ�������ʵ�ֳ������룮
��д��������Һ��Fe2O3��Ӧ�����ӷ���ʽ ��
�ڳ�������õ���������Ҫ�ɷ��� ��
��2����1���������õ���Һ�м��뻹ԭ��ʹFe3+ת��ΪFe2+ �� ��ϱ�������ԭ�� ��
���� | Fe��OH��2 | Fe��OH��3 | Al��OH��3 |
�������䣨pH�� | 7.06��8.95 | 1.94��3.20 | 3.69��4.8 |
��3��ʹ�ü��Խ����İ�ˮΪpH���ڼ������з���ʵ�飮
�ٰ�ˮʹ��Һ�������ӳ��������ӷ���ʽΪ ��
�ڷ�Ӧ�յ��pH������������Ч����Ӱ����ͼ1������ʵ������Ϊ�ﵽ�õķ���Ч������Ӧ�����п���pH�ķ�Χ�� �� ѡ��÷�Χ�������� �� 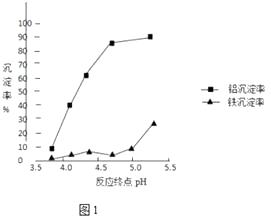
��4����NH4HSO4��H2SO4�����ʵ�����1��1������Ƴɽ�ȡҺ��220��ʱ���ɽ�������ú����Al2O3ת��Ϊ�������[NH4Al��SO4��2]��Ȼ����롢���ջ�ô�Al2O3 ��
��֪������泥����ܽ�ȣ�0��ʱ��S=5.2g��100��ʱ��S=421.9g��
��280��ʱ�ֽ⣮
�������Ͽ�֪��������������������ʷ���ķ����� ��
��5������NH4Al��SO4��2ͬʱ�õ�������壨NH3��N2��SO2��SO3��H2O������16mol������尴ͼ2װ�ñ���ȫ�����Ƶý�ȡҺ���뽫ͼ2���Լ��������ʵ�������������
���𰸡�
��1��6H++Fe2O3=2Fe3++3H2O,SiO2
��2��Fe��OH��3��Al��OH��3������pH���,����ͨ����������
��3��3NH3?H2O+Al3+=Al��OH��3+3NH4+,��С��5,��Ԫ�س����϶�,��Ԫ�ػ�û�п�ʼ�����ij���
��4����ȴ���ᾧ
��5��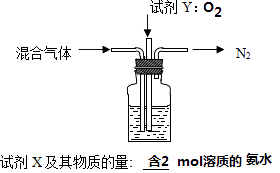
���������⣺��1����������Һ��Fe2O3��Ӧ�����ӷ���ʽΪ6H++Fe2O3=2Fe3++3H2O�����Դ��ǣ�6H++Fe2O3=2Fe3++3H2O��
��SiO2�������ᷴӦ�����������õ���������Ҫ�ɷ���SiO2��
���Դ��ǣ�SiO2��
��2����1���������õ���Һ�м��뻹ԭ��ʹFe3+ת��ΪFe2+���ɱ������ݿ�֪����Fe��OH��3��Al��OH��3������pH���������ͨ���������룬
���Դ��ǣ�Fe��OH��3��Al��OH��3������pH���������ͨ���������룻
��3���ٰ�ˮʹ��Һ�������ӳ��������ӷ���ʽΪ3NH3H2O+Al3+=Al��OH��3+3NH4+��
���Դ��ǣ�3NH3H2O+Al3+=Al��OH��3+3NH4+��
�ڷ�Ӧ�յ��pH������������Ч����Ӱ����ͼ1������ʵ������Ϊ�ﵽ�õķ���Ч������Ӧ�����п���pH�ķ�Χ����С��5 ������4.5��5֮����ɣ�������Ԫ�س����϶࣬��Ԫ�ػ�û�п�ʼ�����ij�����
���Դ��ǣ���С��5����Ԫ�س����϶࣬��Ԫ�ػ�û�п�ʼ�����ij�����
��4������Ϣ��֪���ܽ�����¶�Ӱ���������������������ʷ���ķ�������ȴ���ᾧ��
���Դ��ǣ���ȴ���ᾧ��
��5������ʱ����4NH4Al��SO4��2 ![]() 2Al2O3+5SO3��+3SO2��+2NH3��+N2��+5H2O������ͼ��֪�����ų����Լ�Y���������������Լ�X���������������Լ�YΪO2��16mol������庬2mol��������������Sԭ���غ�ɵõ�8mol��������NH4HSO4��H2SO4�����ʵ�����1��1������Ƴɽ�ȡҺ����8SO3��4NH3�����Լ�XΪ��2mol���ʵİ�ˮ��
2Al2O3+5SO3��+3SO2��+2NH3��+N2��+5H2O������ͼ��֪�����ų����Լ�Y���������������Լ�X���������������Լ�YΪO2��16mol������庬2mol��������������Sԭ���غ�ɵõ�8mol��������NH4HSO4��H2SO4�����ʵ�����1��1������Ƴɽ�ȡҺ����8SO3��4NH3�����Լ�XΪ��2mol���ʵİ�ˮ��
���Դ��ǣ�  ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ���˵����ȷ����
A. ��Щ�����Ǵ������Щ�����ǻ����
B. ���塢��Һ����Һ�ı����������ܷ���������ЧӦ
C. ���岻�����
D. �����ɢ�����ӵ�ֱ����10-9��10-7cm
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cl2ͨ�����Ϊ40mL������������Һ�У�����ǡ����ȫ��Ӧ����÷�Ӧ����Һ�������ֺ���Ԫ�ص����ӣ�����ClO�����ʵ���Ϊ0.06mol��ClO3�����ʵ���0.03mol���밴Ҫ�������������
��1���÷�Ӧ�����ӷ���ʽΪ___________________________________________��
��2���÷�Ӧ�У��������뻹ԭ�����ʵ���֮��Ϊ____________________��
��3��������Ӧ�У�ͨ��Cl2�����ʵ���Ϊ________mol������������Һ�����ʵ���Ũ��Ϊ________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. Ħ����һ�������� B. �����Ħ��������98 g
C. ���ʵ����������ʵ�������Ŀ D. 18 gˮ�к���1 mol H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ݻ�Ϊ2L���ܱ������У�����0.8mol A2�����0.6mol B2���壬һ�������·������·�Ӧ��A2��g��+B2��g���T2AB��g����H��0����Ӧ�и����ʵ�Ũ����ʱ��ı仯�����ͼ��ʾ������˵����ȷ���ǣ� �� 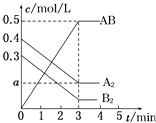
A.ͼ��a���ֵΪ0.05
B.�÷�Ӧ��ƽ�ⳣ��K=0.03
C.ƽ��ʱA2��ת����Ϊ62.5%
D.�¶����ߣ�ƽ�ⳣ��Kֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() ��b����
��b����![]() ��d����
��d����![]() ��p���ķ���ʽ��ΪC6H6������˵����ȷ���ǣ� ��
��p���ķ���ʽ��ΪC6H6������˵����ȷ���ǣ� ��
A. b��ͬ���칹��ֻ��d��p����
B. ���ǵĶ��ȴ����ֻ������
C. ���Ǿ��������Ը��������Һ��Ӧ
D. ֻ��b������ԭ�Ӵ���ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����������ͨ�뺬��Fe3+��Fe2+��Cl-��Br-����Һ�У�����Ũ�ȿ��ܱ��ֲ�����ǣ���������Һ����ı仯���� ��
A.Br-B.Fe2+C.Cl-D.Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������������ϳɰ���ӦΪ��N2��g��+3H2��g���T2NH3��g����H=��92kJmol��1��ش��������⣺
��1��ȡ1mol N2��g����3molH2��g������һ�ܱ������У�һ�������½��з�Ӧ����ƽ��ʱ����÷�Ӧ�ų�������92kJ������ڡ��������ڡ���С�ڡ�����ԭ�������������¶ȣ�������Ӧ�С�H����������С�����䡱����
��2����֪���ֱ��ƻ�1molN��H����1mol H��H����Ҫ���յ�����Ϊ��391kJ��436kJ�����ƻ�1mol N��N����Ҫ���յ�����Ϊ ��
��3��һ�������£������Ϊ2L�ĺ����ܱ������г���1molNH3��g�� ������������Ӧ������Ӻ�Ӧ�ﵽƽ�⣬���v��NH3��=0.40mol/��Lmin�����������ϳɰ���Ӧ��ƽ�ⳣ��Ϊ ��
��4�������������Ϊ1L�ĺ����ܱ������зֱ����1molN2��3molH2 �� ���ֱ�ֻ�ı�����һ���������ʱʹ��Ӧ�ﵽƽ�⣬��ð������������ʱ��ı仯��ͼ��ʾ�� 
����ͼ���У�ֻ�ı��¶ȵ�Ϊ���I����II����III������ͬ����ֻ�ı�ѹǿ��Ϊ �� ֻ�ı������Ϊ ��
��5�����ѱ�״����8.96L����ͨ�뵽100g9.8%��������Һ�в���ȫ���գ�������Һ������Ũ�ȴӴ�С��˳���� ��
��6�������£���Ũ�Ⱦ�Ϊ0.1mol/L��MgCl2��FeCl3��AlCl3�����Һ��ͨ��NH3���������������ɳ����Ļ�ѧʽΪ �� ��pH=ʱ����ʼ����Mg��OH��2������ ����֪��Ksp[Mg��OH��2]=1.0��10��13�� Ksp[Fe��OH��3]=1.0��10��40��Ksp[Al��OH��3]=1.0��10��33��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�ͭ���仯��������ʶԿ��С�������������Ҫ�����壮
��1��ͭ�ɲ������·����Ʊ�
�ٻ���ͭ��Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
��ʪ����ͭ��CuSO4+Fe�TFeSO4+Cu
�������ַ����У�ͭԪ�ؾ��� �����������ԭ������ͭ���ʣ����âٷ�ÿ�Ƶ�32gCu��ת�Ƶ��ӵ����ʵ����� ��
��2���ڳ�ʪ�Ŀ�����ͭ���Է����绯ѧ��ʴ������ͭ�̣�ͭ�̵Ļ�ѧʽΪ ������ʴ��������ӦʽΪ�� ����ͭ��п��ɵĻ�ͭ�Ͻ������⣬�����ʴ�ķ����� ��
��3����Li����CuO����ܷ�ӦΪ��2Li+CuO�TLi2O+Cu���������ҺΪ��������л���Һ����ص�������ӦʽΪ�� ����
��Cu2O��һ�ְ뵼����ϣ����ڼ�����Һ���õ�ⷨ��ȡ������ܷ�ӦʽΪ��
2Cu+H2O![]() Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
��4��Ϊ�˻��մ�ͭ�������������е�Ag��Au��ijʵ��С��������й��������±���
��� | �����·�Ӧ | ��ѧƽ�ⳣ�� |
��Ӧ�� | Au+6HNO3Au��NO3��3+3NO2��+3H2O | ��10��5 |
��Ӧ�� | Au3++4Cl��[AuCl4]�� | ��105 |
�������п�֪�������½���������ᷴӦ����ȴ��������ˮ��Ũ������Ũ���������Ϊl��3�Ļ������������û�ѧƽ���ƶ�ԭ������Ҫ˵������������ˮ��ԭ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com