
����Ŀ���о�ͭ���仯��������ʶԿ��С�������������Ҫ�����壮
��1��ͭ�ɲ������·����Ʊ�
�ٻ���ͭ��Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
��ʪ����ͭ��CuSO4+Fe�TFeSO4+Cu
�������ַ����У�ͭԪ�ؾ��� �����������ԭ������ͭ���ʣ����âٷ�ÿ�Ƶ�32gCu��ת�Ƶ��ӵ����ʵ����� ��
��2���ڳ�ʪ�Ŀ�����ͭ���Է����绯ѧ��ʴ������ͭ�̣�ͭ�̵Ļ�ѧʽΪ ������ʴ��������ӦʽΪ�� ����ͭ��п��ɵĻ�ͭ�Ͻ������⣬�����ʴ�ķ����� ��
��3����Li����CuO����ܷ�ӦΪ��2Li+CuO�TLi2O+Cu���������ҺΪ��������л���Һ����ص�������ӦʽΪ�� ����
��Cu2O��һ�ְ뵼����ϣ����ڼ�����Һ���õ�ⷨ��ȡ������ܷ�ӦʽΪ��
2Cu+H2O![]() Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
��4��Ϊ�˻��մ�ͭ�������������е�Ag��Au��ijʵ��С��������й��������±���
��� | �����·�Ӧ | ��ѧƽ�ⳣ�� |
��Ӧ�� | Au+6HNO3Au��NO3��3+3NO2��+3H2O | ��10��5 |
��Ӧ�� | Au3++4Cl��[AuCl4]�� | ��105 |
�������п�֪�������½���������ᷴӦ����ȴ��������ˮ��Ũ������Ũ���������Ϊl��3�Ļ������������û�ѧƽ���ƶ�ԭ������Ҫ˵������������ˮ��ԭ�� ��
���𰸡���ԭ��1.5mol��Cu2��OH��2CO3��Cu2��OH��2CO3��O2+2H2O+4e��=4OH��������������������CuO+2e��+2Li+=Li2O+Cu��2Cu��2e��+2OH��=Cu2O+H2O��Cu2O+2H+=Cu2++Cu+H2O��Ũ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���[AuCl4]�����ӣ�ʹ��Ӧ��ƽ�������ƶ�����Au������ˮ��
����������1��������Ӧ��CuԪ�ػ��ϼ���+2�ۻ�+2��ת��Ϊ0�ۣ�������ԭ��Ӧ������CuԪ�ر���ԭ�����âٷ�ÿ�Ƶ�32gCu��n��Cu��=![]() =0.5mol����Ҫ����ͭ�����ʵ���Ϊ0.25mol��ת�Ƶ��ӵ����ʵ���=0.25mol��[4������2��]=1.5mol��
=0.5mol����Ҫ����ͭ�����ʵ���Ϊ0.25mol��ת�Ƶ��ӵ����ʵ���=0.25mol��[4������2��]=1.5mol��
���Դ��ǣ���ԭ�� 1.5mol��
��2��Cu��������������̼��ˮ��Ӧ����Cu2��OH��2CO3 �� ����ͭ�̵Ļ�ѧʽΪCu2��OH��2CO3 �� �����������õ��Ӻ�ˮ��Ӧ�������������ӣ��缫��ӦʽΪO2+2H2O+4e��=4OH����Zn��Cu�͵���ʹ���ԭ��أ�Zn��ʧ���Ӷ���������Cu���������������������÷���Ϊ�������������������Դ��ǣ�
Cu2��OH��2CO3��O2+2H2O+4e��=4OH��������������������
��3����������CuO�õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪCuO+2e��+2Li+=Li2O+Cu�����Դ��ǣ�CuO+2e��+2Li+=Li2O+Cu��
��������ͭʧ���Ӻ����������ӷ�Ӧ����������ͭ��ˮ���缫��ӦʽΪ2Cu��2e��+2OH��=Cu2O+H2O��������ͭ��ϡ���ᷴӦ��������ͭ��Cu��ˮ�����ӷ���ʽΪCu2O+2H+=Cu2++Cu+H2O�����Դ��ǣ�2Cu��2e��+2OH��=Cu2O+H2O�� Cu2O+2H+=Cu2++Cu+H2O��
��4��Ũ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���[AuCl4]�����ӣ�ʹ��Ӧ��ƽ�������ƶ�����Au������ˮ�У����Դ��ǣ�Ũ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���[AuCl4]�����ӣ�ʹ��Ӧ��ƽ�������ƶ�����Au������ˮ�У�


 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ú�ң���Ҫ����SiO2��Fe2O3��Al2O3�ȣ���ȼú��������в����ķ�������ú�ҵ��ۺ����þ��кܴ�ļ�ֵ��
���о���Աͨ��ʵ��Է�ú����������Ԫ�صķ��빤�ս������о���
��1����������Һ�ֽ��ú�ң�ʹ���е�������Ԫ���ܳ�������ʵ�ֳ������룮
��д��������Һ��Fe2O3��Ӧ�����ӷ���ʽ ��
�ڳ�������õ���������Ҫ�ɷ��� ��
��2����1���������õ���Һ�м��뻹ԭ��ʹFe3+ת��ΪFe2+ �� ��ϱ�������ԭ�� ��
���� | Fe��OH��2 | Fe��OH��3 | Al��OH��3 |
�������䣨pH�� | 7.06��8.95 | 1.94��3.20 | 3.69��4.8 |
��3��ʹ�ü��Խ����İ�ˮΪpH���ڼ������з���ʵ�飮
�ٰ�ˮʹ��Һ�������ӳ��������ӷ���ʽΪ ��
�ڷ�Ӧ�յ��pH������������Ч����Ӱ����ͼ1������ʵ������Ϊ�ﵽ�õķ���Ч������Ӧ�����п���pH�ķ�Χ�� �� ѡ��÷�Χ�������� �� 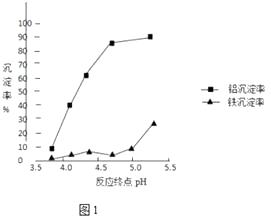
��4����NH4HSO4��H2SO4�����ʵ�����1��1������Ƴɽ�ȡҺ��220��ʱ���ɽ�������ú����Al2O3ת��Ϊ�������[NH4Al��SO4��2]��Ȼ����롢���ջ�ô�Al2O3 ��
��֪������泥����ܽ�ȣ�0��ʱ��S=5.2g��100��ʱ��S=421.9g��
��280��ʱ�ֽ⣮
�������Ͽ�֪��������������������ʷ���ķ����� ��
��5������NH4Al��SO4��2ͬʱ�õ�������壨NH3��N2��SO2��SO3��H2O������16mol������尴ͼ2װ�ñ���ȫ�����Ƶý�ȡҺ���뽫ͼ2���Լ��������ʵ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KMnO4��һ�ֵ��͵�ǿ�����������������գ�
������KMnO4������Һ����Cu2S��CuS�Ļ����ʱ�������ķ�Ӧ���£�
�� MnO4��+ Cu2S + H+�� Cu2+ + SO2�� + Mn2+ + H2O (δ��ƽ)
�� MnO4��+ CuS + H+ �� Cu2+ + SO2�� + Mn2+�� H2O (δ��ƽ)
��1�����й��ڷ�Ӧ�ٵ�˵���д������_________��ѡ���ţ���
a����������Ԫ����Cu��S b���������뻹ԭ�������ʵ���֮��Ϊ8:5
c����ԭ�Ե�ǿ����ϵ�ǣ� Mn2+<Cu2S d��ÿ����2.24 L(���) SO2��ת��0.6mol����
��2����ƽ�������Ӧ���е���ת�Ƶķ������Ŀ��_____
MnO4��+ CuS + H+ �� Cu2+ + SO2�� + Mn2+�� H2O
��3������H2O2����KMnO4�з�Ӧ��2KMnO4+7H2O2+3H2SO4= K2SO4+2MnSO4+6O2��+10H2O����1molKMnO4������H2O2��_________mol��
II����֪�ڼ��������£�MnO4����e������MnO42�� (��ɫ)
��4�� ��KMnO4��Һ����NaOH��Һ���ȣ��õ�������ɫ��Һ���������������ɣ�д����Ӧ�����ӷ���ʽ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2�������Ϊ��Ҫԭ����ȡ1��2��������ʱ����Ҫ�����ķ�Ӧ�����ǣ� ��
A.�ӳɡ���ȥ��ȡ��
B.��ȥ���ӳɡ�ȡ��
C.ȡ������ȥ���ӳ�
D.ȡ�����ӳɡ���ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ��Ⱦ��Ϊ���������͵���������о���Ա�����ͬʱ���������ж�������͵���������ķ���������ת��Ϊ��������ᣬ�����������£�

�����з����ķ�Ӧ���£�
��������NO2+SO2+H2O==H2SO4+NO
�������NO+NO2==N2O3��N2O3+2H2SO4==2NOHSO4�����壩+H2O
�ֽ�����4NOHSO4�����壩+O2+2H2O==4H2SO4+4NO2
��1�����ʢٺ͢ڷֱ�Ϊ���ѧʽ��________��__________��
��2��д��SO2��O2��H2O��Ӧ����H2SO4�Ļ�ѧ����ʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CH3��CH�TCH2+HBr������CH3��CHBr��CH3����Ҫ�����1molij��A���ȼ�պ���Եõ�8mol CO2��4mol H2O������A�ڲ�ͬ�������ܷ�����������ʾ��һϵ�б仯�� 
��1��A�Ļ�ѧʽ�� �� A�Ľṹ��ʽ ��
��2��������Ӧ�У�������Ӧ��������Ӧ�����Ӧ���ͣ�
��3��д��C��D��E��H���ʵĽṹ��ʽ��C �� D �� E �� H ��
��4��д����Ӧ�Ļ�ѧ����ʽ ![]() �� д���߷�Ӧ�Ļ�ѧ����ʽ
�� д���߷�Ӧ�Ļ�ѧ����ʽ ![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮռ�����ܴ�ˮ����97.2%�����Ѻ�ˮ�����ͻ�����������������ȿ��Խ����ˮ��Դȱ�������⣬�ֿ��Գ�����ú�����Դ��
��1����ˮ�к��д������Ȼ��ơ��Ȼ����еĽ���Ԫ��λ��Ԫ�����ڱ���________�塣
��2��Ŀǰ������ʹ�õġ���ˮ��������Ҫ����֮һ�����������ǽ���ˮ�������������������ȴ���øߴ��ȵ�ˮ���ɴ˿��ж�������________(������仯����ѧ�仯��)��
��3����ҵ�����õ�ⱥ��ʳ��ˮ���Ƶ���Ҫ������Ʒ����Ӧ����ʽΪ��2NaCl��2H2O2NaOH��H2����Cl2�������õ������������36.5%��Ũ����1000 t��������Ҫ����ʳ��________t��
��4�����������������һ�������ȼҵ��Ʒ���Ȼ���ѭ������������������������ն�������ķ������÷������������£�
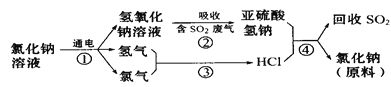
д���ڢܵĻ�ѧ��Ӧ����ʽ______________________________�� _________________��
��5�������������������ȩ����һ����Ӧ�����Ժϳ��׳ơ����顱�����ʡ������������к�����������ʳƷƯ�ס���ṹ��ʽΪHOCH2SO3Na��������ṹ�ص㣬�����顱�ܷ����ķ�Ӧ��________��
A��������Ӧ B���ۺϷ�Ӧ C��������Ʒ�Ӧ D��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨ��ҵ������Na2CO3������������������NaCl�����ס�����λѧ���ֱ������һ������ѧ����ʵ��������ͼ��ʾ��
ѧ������Ƶ�ʵ�鲽�����£�
�ٳ�ȡ��Ʒ��Ϊ1.150g��
���ܽ�����250mL��Һ��
��ȡ20mL������Һ��������� 2��3�Σ�
����0.1140mol/L�ı�������еζ���
�����ݴ�����
�ش��������⣺
��1����ѧ����Ƶķ������Լ�A����ѡ�������ţ�
a��CaCl2 b��BaCl2 c��AgNO3
��2���������Ӧ���������ν��Т�������ʵ��������裮���У�֤��ǰ��һ���IJ����Ѿ���ɵķ�������
��3��ѧ����ij��ʵ�鿪ʼ�ζ�ʱ��������Һ�Ŀ̶���0.00mL����������ʱ�ﵽ�ζ��յ㣬��ʱ������Һ�Ŀ̶���14.90mL������ͬѧ�Ըô�ʵ�����ݼ������Ʒ��Na2CO3��������������������λС��������ͬѧ�����ʵ��������ʦ����������ֵ�dz��ӽ�������ʦ�����϶�����ʵ�鷽����Ʋ��ϸ�����Ϊ���ܵ�ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е����λ����ͼ��ʾ������˵����ȷ����( )

A. Ԫ��X��Ԫ��Z����������ϼ�֮�͵���ֵ����8
B. ԭ�Ӱ뾶�Ĵ�С˳��Ϊ��r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. ����Y2-��Z3+�ĺ���������͵��Ӳ���������ͬ
D. Ԫ��W������������Ӧ��ˮ��������Ա�Q��ǿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com