
【题目】为了测定工业纯碱中Na2CO3的质量分数(含少量NaCl),甲、乙两位学生分别设计了一套方案。学生甲的实验流程如图所示:
学生乙设计的实验步骤如下:
①称取样品,为1.150g;
②溶解后配成250mL溶液;
③取20mL上述溶液,加入甲基橙 2~3滴;
④用0.1140mol/L的标准盐酸进行滴定;
⑤数据处理.
回答下列问题:
(1)甲学生设计的方案中试剂A可以选用(填编号)
a.CaCl2 b.BaCl2 c.AgNO3
(2)操作Ⅱ后还应对滤渣依次进行①②两个实验操作步骤.其中,证明前面一步的操作已经完成的方法是。
(3)学生乙某次实验开始滴定时,盐酸溶液的刻度在0.00mL处,当滴至时达到滴定终点,此时盐酸溶液的刻度在14.90mL处,乙同学以该次实验数据计算此样品中Na2CO3的质量分数是(保留两位小数).乙同学的这次实验结果与老师给出的理论值非常接近,但老师最终认定他的实验方案设计不合格,你认为可能的原因是。
【答案】
(1)ab
(2)洗涤;烘干;取最后一次洗涤液,加入AgNO3无沉淀证明洗涤干净
(3)黄色至橙色,半分钟不褪色;0.98或97.85%;没有做平行试验取平均值
【解析】(1)为了测定工业纯碱中Na2CO3的质量分数(含少量NaCl),加入沉淀剂后将碳酸根离子转化成沉淀,可以用CaCl2、BaCl2 , 由于硝酸银溶液能够与碳酸根离子、氯离子发生反应都形成沉淀,所以不能使用硝酸银溶液,故正确选项为:ab;
(2)称量沉淀的质量前,为了减小误差,需要对沉淀进行洗涤、烘干操作,从而除去沉淀中的氯化钠、水;检验沉淀已经洗涤干净的操作方法为:取最后一次洗涤液,加入AgNO3无沉淀证明洗涤干净;
(3)用甲基橙作指示剂,甲基橙在碱性溶液中,开始溶液为黄色,由于甲基橙的变色范围是3.1~4.4,当达到滴定终点4.4时,溶液会由黄色变为橙色,则滴定终点的现象为:溶液由黄色变为橙色,且半分钟不褪色;盐酸溶液的刻度在14.90mL处,消耗HCl的物质的量为:n(HCl)= 0.1140mol/L×0.01490L= 0.0016986mol,根据关系式Na2CO3~2HCl可知,20mL该溶液中含有碳酸钠的物质的量为:(0.0016986mol÷2)=0.0008493mol,则250mL溶液中含有的碳酸钠的物质的量为:0.0008493mol×250mL÷20mL=0.01061625mol,所以样品中碳酸钠的质量分数为: [(106g/mol×0.01061625mol)÷1.150g]×100%=97.85%或0.98;滴定操作测量纯度时,为了减小误差,需要多次滴定取平均值,而乙同学没有没有做平行试验取平均值,所以设计的方案不合格。
(1)根据沉淀碳酸根离子需要加入的试剂进行分析;
(2)根据定量分析中洗涤烘干等进行判断,结合氯离子的检验判断洗涤的结果;
(3)根据中和滴定操作进行判断。


科目:高中化学 来源: 题型:
【题目】已知:氮气和氢气合成氨反应为:N2(g)+3H2(g)═2NH3(g)△H=﹣92kJmol﹣1请回答下列问题:
(1)取1mol N2(g)和3molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量92kJ(填“大于”、“等于”或“小于”),原因是;若升高温度,上述反应中△H(填“变大”、“变小”或“不变”).
(2)已知:分别破坏1molN﹣H键、1mol H﹣H键需要吸收的能量为:391kJ、436kJ,则破坏1mol N≡N键需要吸收的能量为 .
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molNH3(g) 并发生上述反应.半分钟后反应达到平衡,测得v(NH3)=0.40mol/(Lmin),则上述合成氨反应的平衡常数为 .
(4)向三个体积均为1L的恒容密闭容器中分别充入1molN2和3molH2 , 当分别只改变其中一个外界条件时使反应达到平衡,测得氨的体积分数随时间的变化如图所示. 
上述图像中,只改变温度的为(填“I”“II”“III”,下同),只改变压强的为 , 只改变催化剂的为 .
(5)若把标准状况下8.96L氨气通入到100g9.8%的硫酸溶液中并完全吸收,所得溶液中离子浓度从大到小的顺序是 .
(6)常温下,向浓度均为0.1mol/L的MgCl2、FeCl3和AlCl3混合溶液中通入NH3至过量,最先生成沉淀的化学式为 , 当pH=时,开始生成Mg(OH)2沉淀. (已知:Ksp[Mg(OH)2]=1.0×10﹣13; Ksp[Fe(OH)3]=1.0×10﹣40;Ksp[Al(OH)3]=1.0×10﹣33)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究铜及其化合物的性质对科研、生产生活有重要的意义.
(1)铜可采用如下方法制备
①火法炼铜:Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
②湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质,若用①法每制得32gCu,转移电子的物质的量是 .
(2)在潮湿的空气中铜可以发生电化学腐蚀,生成铜绿,铜绿的化学式为 发生腐蚀的正极反应式为 ,由铜和锌组成的黄铜合金不易生锈,其防腐蚀的方法是 .
(3)①Li﹣﹣CuO电池总反应为:2Li+CuO═Li2O+Cu.电解质溶液为高氯酸锂有机溶液,电池的正极反应式为 .
②Cu2O是一种半导体材料,可在碱性溶液中用电解法制取,电解总反应式为:
2Cu+H2O![]() Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .
Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .
(4)为了回收粗铜精炼后阳极泥中的Ag和Au,某实验小组查阅了有关资料如下表:
编号 | 常温下反应 | 化学平衡常数 |
反应甲 | Au+6HNO3Au(NO3)3+3NO2↑+3H2O | <10﹣5 |
反应乙 | Au3++4Cl﹣[AuCl4]﹣ | >105 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为l:3的混合物).请你运用化学平衡移动原理,简要说明金能溶于王水的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
A.平衡时X、Y的转化率相同
B.达到平衡后,将容器体积压缩为1L,平衡向正反应方向移动
C.T℃时,该反应的化学方程式为:X(g)+Y(g) ![]() 2Z(g),平衡常数K=40
2Z(g),平衡常数K=40
D.T℃时,若起始时X为0.71mol,Y为1.00mol,则平衡时Y的转化率约为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
写出氨气催化氧化生成一氧化氮气体和水蒸气的热化学反应方程式。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) ![]() 2NH3(g)反应的影响,实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)反应的影响,实验结果如图所示:(图中T表示温度,n表示物质的量)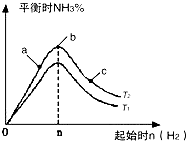
①图象中T2和T1的关系是:T2T1(填“高于”、“低于”、“等于”、“无法确定”).
②若比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是(填字母).
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) ![]() 4NO2(g) + O2(g).△H﹥0,下表为反应在T1温度下的部分实验数据:
4NO2(g) + O2(g).△H﹥0,下表为反应在T1温度下的部分实验数据:
| 0 | 500 | 1000 |
| 5.00 | 3.52 | 2.48 |
①500s内NO2的平均生成速率为。
②该反应的化学平衡常数表达式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列五种基团,﹣CH3、﹣OH、﹣CHO、﹣C6H5、﹣COOH,两两组成的物质中,能与NaOH反应的物质有多少种( )
A.4种
B.5种
C.6种
D.7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述中正确的是
A. 一种元素被氧化,肯定另一种元素被还原
B. 反应中不一定所有元素的化合价都发生变化
C. 某元素由化合物变为单质,则该元素一定被还原
D. 氧化还原反应中一定有得氧或失氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.摩尔既是物质的量的单位,又是粒子的数量单位
B.2 mol O2的摩尔质量是64 g/mol
C.摩尔质量在数值上与1mol该物质的质量相等
D.1 mol SO2中含有2 mol O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使K2S溶液中 ![]() 的比值变小,可加入的物质是( ) ①适量HCl(g)
的比值变小,可加入的物质是( ) ①适量HCl(g)
②适量NaOH(s)
③适量KOH(s)
④适量NaHS(s)
⑤适量的水.
A.②④
B.①②⑤
C.③④⑤
D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com