
����˵����ȷ����
| A�������£���pH=11�İ�ˮϡ�͵�ԭ�����10������Һ��pH=10 |
| B��Ϊȷ��ij�ᣮH2A��ǿ�ỹ�����ᣬ�ɲ�NaHA��Һ��pH����pH>7����H2A�������pH<7����H2A��ǿ�� |
| C����0��2000 mol/L NaOH����Һ�ζ�HCl��CH3COOH�Ļ����Һ(���Һ���������Ũ�Ⱦ�ԼΪ0��1mol/L)��������ʱ����Һ�е���δ����ȫ�к� |
| D����ͬ�¶��£��������Ȼ�������ֱ������ͬ����Ģ�����ˮ��0��1 mol/L���� ��0��1 mol/L�Ȼ�þ��Һ��0��1 mol/L��������Һ�У���Ag+Ũ�ȣ���>��=��>�� |
C
�������������A������ȷ����ˮ�����������ȫ���룬��pH=11�İ�ˮϡ�͵�ԭ�����10������Һ��pH����10��B������ȷ����NaHA��Һ��pH����pH>7��˵��HA�D��ˮ����ڵ��룻C����ȷ��CH3COOH�����ᣬCH3COONaˮ���ʼ��ԣ�����Ҫ��CH3COOH��ȫ�кͣ�NaOH�������D����ȷ�������Ȼ��������ڢ�����ˮ���������0��1 mol/L�����е���̶ȼ�С ��0��1 mol/L�Ȼ�þ��Һ��Cl�DΪ0��2 mol/L��AgCl����С�ڢ��еĵ��룻��0��1 mol/L��������Һ��Ag�� Ũ�������Cl�DŨ����ͬ����AgCl��������Ƴ̶���ͬ������Ag+Ũ�ȣ���>��=��>�ۣ�ѡC��
���㣺������ʵĵ���ƽ�⼰��Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����I����Cl����ϡ��Һ�е���AgNO3��Һ�����������������AgNO3��Һ����Ĺ�ϵ����ͼ��ʾ����ԭ��Һ��c(I��)/c(Cl��)�ı�ֵΪ( )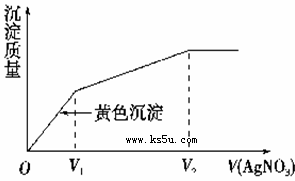
| A��(V2��V1)/V1 | B��V1/V2 |
| C��V1/(V2��V1) | D��V2/V1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ���¶��£��Ȼ�����ˮ�д����ܽ�ƽ�� AgCl��s�� Ag����aq����Cl����aq��������AgCl�ֱ���� ��100mLˮ�У���50mL0.1mol/L NaCl��Һ�У���10mL0.1mol/LAgNO3��Һ�У���20mL0.1mol/L MgCl2��Һ�С����������ͬ���¶���Ag��Ũ���ɴ�С��˳���ǣ�
Ag����aq����Cl����aq��������AgCl�ֱ���� ��100mLˮ�У���50mL0.1mol/L NaCl��Һ�У���10mL0.1mol/LAgNO3��Һ�У���20mL0.1mol/L MgCl2��Һ�С����������ͬ���¶���Ag��Ũ���ɴ�С��˳���ǣ�
| A���ۣ��٣��ڣ��� | B���ڣ��٣��ܣ��� | C���ܣ��ۣ��ڣ��� | D���٣��ۣ��ܣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪0.1mol L-1�Ķ�Ԫ��H2A��Һ��pH=4.0������˵������ȷ����
L-1�Ķ�Ԫ��H2A��Һ��pH=4.0������˵������ȷ����
A����Na2A��NaHA����Һ�У����������ͬ
B�����������ʵ�����ȵ�Na2A��NaHA����Һ���У�2c(Na+)=3c(A2-)+3c(HA-)+3c(HA)
C����NaHA��Һ��һ���У�c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D����Na2A��Һ��һ���У�c(Na+)��c(A2-)��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����й�ʵ���ԭ���������ͽ��۶���ȷ����
| A�������������pH������������Һ�Ͱ�ˮ�ֱ�ϡ����ͬ��������ˮ��pH�仯�� |
| B����CH3COOH��Һ��������ʵ�飬�ƹ�ϰ���˵��CH3COOH��������� |
| C������з�̪��Na2CO3��Һ����μ���Ba��NO3��2����ɫ����ȥ��˵��Na2CO3��Һ�д���ˮ��ƽ�� |
| D����ˮ�еμ���������FeCl3��Һ���γɴ���Ľ��壬����������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����(NH4)2SO4��Һ������˵����ȷ����
A����Һ�д��ڵ���ƽ�⣺(NH4)2SO4 2NH4+ + SO42�� 2NH4+ + SO42�� |
| B������Һ�еμ�����Ũ���ᣬc(NH4+)��c(SO42��)������ |
| C����ˮϡ�ͣ���Һ���������ӵ�Ũ�Ⱦ���С |
| D����Һ�У�c(SO42��)��2c(NH4+) + 2c(NH3��H2O) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij��ѧʵ����ȤС��ͬѧ���ô���ʯ��ϡ�����Ʊ�CO2�����Һ�еμ�̼������Һ������Һ�в���pH�����������pH�仯������ͼ��ʾ�������й�˵������ȷ����
| A����ʼʱ��ҺpH=2����Ϊ����Һ�л�������ʣ�� |
| B��AB�α�ʾ����̼������Һ�ĵ��룬CaCO3���������������� |
| C��BC�η����ķ�ӦΪ��Ca2++CO32-= CaCO3�� |
| D������500��̼������Һ����Һ��c(OH-)>c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����й���Һ������Ũ�ȵĹ�ϵ������ȷ����
| A��NaHCO3��Һ�д��ڣ�c(OH��)��c(H2CO3)��c(H��) |
| B�������£�pH��3�������pH��ll�İ�ˮ�������Ϻ���Һ�У�c(NH4��)��c(Cl��) |
| C��0.2 mol/LNH4Cl��Һ��0.1 mol/L NaOH��Һ�������Ϻ���Һ�У�c(NH4��)��c(Na��) |
| D��0.2 mol/L �� CH3COOH ��Һ��c(H��)С��0.1 mol/L �� CH3COOH ��c(H��)������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪t��ʱ��Ksp[Al(OH)3]=l��l0-33��Ksp[Mg(OH)2]=4��10-12���ں���0.20 mol��L H+��c(Mg2+)=c(A13+)=0.10mol/L����Һ�в��ϼ���KOH��Һ������������m(����)�����KOH��Һ�����V[KOH(aq)]��ϵ��ʾ��ͼ��ȷ����( )
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com