
【题目】(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:![]() 。放电时,正极的电极反应式为 ______ ,充电时,该电极应与电源的 ______
。放电时,正极的电极反应式为 ______ ,充电时,该电极应与电源的 ______ ![]() 填“正”或“负”
填“正”或“负”![]() 极相连.
极相连.
(2)氨在氧气中燃烧,生成水和氮气。已知:![]() ;
;![]() ,
,![]() ;
;![]() ,则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为: ______ 。
,则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为: ______ 。
(3)研究表明工业上合成氨反应![]() 在
在![]() 、
、![]() 的平衡常数分别为
的平衡常数分别为![]() 和200。
和200。
①合成氨是 ______ 反应![]() 填“放热”或“吸热”
填“放热”或“吸热”![]() 。
。
②合成氨选择![]() 的原因是: ______ 。
的原因是: ______ 。
③在容积固定的密闭容器中发生上述反应,如表中为各物质在不同时刻的浓度:
时间 |
|
|
|
0 |
|
| 0 |
5 |
| X |
|
10 |
|
|
|
![]() ,
,![]() 的平均反应速率
的平均反应速率![]() ______。反应在5分钟时,条件发生了改变,改变的条件可能是 ______
______。反应在5分钟时,条件发生了改变,改变的条件可能是 ______ ![]() 填序号
填序号![]() 。
。
![]() 使用催化剂
使用催化剂 ![]() 降低温度
降低温度 ![]() 增加氢气的浓度
增加氢气的浓度 ![]() 分离出
分离出![]()
(4)在![]() 时,液氨中存在电离平衡
时,液氨中存在电离平衡![]() ,离子积常数
,离子积常数![]() 。若一定条件下,平衡时
。若一定条件下,平衡时![]()
![]() ,下列说法正确的是 ______ 。
,下列说法正确的是 ______ 。
![]() ,液氨的离子积常数增大
,液氨的离子积常数增大
![]() 此温度下液氨的离子积常数为
此温度下液氨的离子积常数为![]()
![]() 液氨在
液氨在![]() 的电离程度比常温下纯水的大
的电离程度比常温下纯水的大
(5)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:![]() ,下列叙述正确的是 ______
,下列叙述正确的是 ______ ![]() 填字母
填字母![]() 。
。
A. 放电时负极反应为:![]()
B. 充电时阳极反应为:![]()
C. 放电时每转移3mol电子,正极有![]() 被氧化。
被氧化。
【答案】![]() 正
正 ![]()
![]() 加快反应速率,催化剂活性最大
加快反应速率,催化剂活性最大 ![]() a b AB
a b AB
【解析】
![]() 放电时,该装置是原电池,正极上得电子发生还原反应,充电时,该电极应与电源的正极相连;
放电时,该装置是原电池,正极上得电子发生还原反应,充电时,该电极应与电源的正极相连;
![]() 根据盖斯定律进行判断;
根据盖斯定律进行判断;
![]() 升高温度,化学平衡常数降低,反应是放热的,反之是吸热的;
升高温度,化学平衡常数降低,反应是放热的,反之是吸热的;
![]() 温度越高,反应速率越快,再结合催化剂活性进行分析;
温度越高,反应速率越快,再结合催化剂活性进行分析;
![]() 先计算氮气的反应速率,再根据氮气和氢气之间的关系计算氢气的反应速率;先计算5min时氢气的浓度,根据氮气、氢气和氨气浓度变化确定反应条件;
先计算氮气的反应速率,再根据氮气和氢气之间的关系计算氢气的反应速率;先计算5min时氢气的浓度,根据氮气、氢气和氨气浓度变化确定反应条件;
![]() 离子积常数只与温度有关;
离子积常数只与温度有关;
![]() 根据
根据![]() 计算液氨的离子积常数;
计算液氨的离子积常数;
![]() 比较液氨和水的离子积常数。
比较液氨和水的离子积常数。
(5)根据高铁电池的总反应![]() 可知,放电时Zn是负极,K2FeO4在正极得电子被还原生成Fe(OH)3,充电时阳极是K2FeO4失去电子生成Fe(OH)3,阴极是Zn(OH)2得到电子生成Zn。
可知,放电时Zn是负极,K2FeO4在正极得电子被还原生成Fe(OH)3,充电时阳极是K2FeO4失去电子生成Fe(OH)3,阴极是Zn(OH)2得到电子生成Zn。
![]() 放电时,正极上NiOOH得电子和水反应生成氢氧化镍和氢氧根离子,电极反应式为:
放电时,正极上NiOOH得电子和水反应生成氢氧化镍和氢氧根离子,电极反应式为:![]() ,充电时,该电极应与电源的正极相连;故答案为:
,充电时,该电极应与电源的正极相连;故答案为:![]() ,正;
,正;
![]() ;
;![]()
![]() ;
;![]() 将方程式
将方程式![]() 得方程式,
得方程式,![]() ;
;![]() ;故答案为:
;故答案为:![]() ;
;![]() ;
;
![]() 升高温度,化学平衡常数减小,说明平衡向逆反应方向移动,所以正反应是放热反应,故答案为:放热;
升高温度,化学平衡常数减小,说明平衡向逆反应方向移动,所以正反应是放热反应,故答案为:放热;
![]() 温度越高,反应速率越大,且在
温度越高,反应速率越大,且在![]() 时催化剂活性最大,所以选择
时催化剂活性最大,所以选择![]() ,故答案为:加快反应速率,催化剂活性最大;
,故答案为:加快反应速率,催化剂活性最大;
![]() ,
,![]() 的平均反应速率
的平均反应速率![]() ,
,![]() ,
,![]() ,氮气浓度的改变量大于前5min的改变量,说明反应速率增大,氮气的浓度在逐渐降低而反应速率在增大,那么改变的条件只能是加入催化剂,故选a;故答案为:
,氮气浓度的改变量大于前5min的改变量,说明反应速率增大,氮气的浓度在逐渐降低而反应速率在增大,那么改变的条件只能是加入催化剂,故选a;故答案为:![]() ,a;
,a;
![]() 离子积常数只与温度有关,温度不变,离子积常数不变,故a错误;
离子积常数只与温度有关,温度不变,离子积常数不变,故a错误;
![]() 此温度下
此温度下![]() ,
,![]() ,故b正确;
,故b正确;
![]() 液氨在
液氨在![]() 的电离常数为
的电离常数为![]() ,常温下纯水的电离常数为
,常温下纯水的电离常数为![]() ,故液氨在
,故液氨在![]() 的电离程度比常温下纯水的小,故c错误;
的电离程度比常温下纯水的小,故c错误;
答案:b;
![]() .放电时负极发生失电子的氧化反应,电极反应为:
.放电时负极发生失电子的氧化反应,电极反应为:![]() ,故A正确;
,故A正确;
B.充电时阳极发生失电子的氧化反应,电极反应为:![]() ,故B正确;
,故B正确;
C.放电时正极转化为:![]() ,
,![]() 被还原要得到3mol电子,故C错误;
被还原要得到3mol电子,故C错误;
答案:AB。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
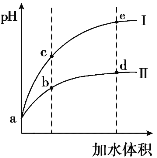
A.曲线II代表HCl的稀释过程
B.溶液中水的电离程度:b点>c点
C.从b点到d点,溶液中![]() 保持不变
保持不变
D.该温度下,b点Kw的数值比e点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集
的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集![]() 的体积在相同状况下分别为
的体积在相同状况下分别为![]() 和
和![]() ,若
,若![]() ,下列说法正确的是
,下列说法正确的是![]()
A.HX可能是强酸
B.NaX水溶液的碱性弱于NaY水溶液的碱性
C.HX一定是弱酸
D.反应过程中二者生成H2的速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2HI(g) ![]() H2(g)+I2(g)反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能)。
H2(g)+I2(g)反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能)。
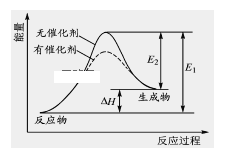
下列有关叙述正确的是 ( )
A.升高温度,反应速率增大,△H减小
B.升高温度,不影响活化分子百分数
C.逆反应的活化能等于正反应的活化能
D.催化剂能降低该反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有常温下浓度均为![]() 的下列四种溶液:
的下列四种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液。
溶液。
(1)这5种溶液pH由大到小的顺序是______,其中由水电离的H+浓度最小的是______。(填序号)
(2)②中各离子浓度由大到小的顺序是______,![]() 的水解平衡常数
的水解平衡常数![]() ______。
______。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
(3)向③中通入少量氨气,此时 的值______(填“增大”、“减小”或“不变”)。
的值______(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______ ④的体积(填“大于”、“小于”或“等于”)。
(5)将②③④的溶液分别蒸干并灼烧,最终可得原溶质的是______(填序号)。
(6)100mL3mol/LH2SO4溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是______(填字母)。
A.加![]() 固体 B.加
固体 B.加![]() 固体 C.加
固体 C.加![]() 溶液 D.加氨水 E.加
溶液 D.加氨水 E.加![]() 溶液
溶液
II.常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是______,发生反应的离子方程式为______,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是______,发生反应的离子方程式为______,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为______mol/L (已知常温下
的溶液为______mol/L (已知常温下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46kJ的热量,表示该反应的中和热的热化学方程式为
A.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) △H=-11.46 kJ·mol-1
K2SO4(aq)+H2O(l) △H=-11.46 kJ·mol-1
B.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46 kJ·mol-1
C.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
D.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为50%
C. 2min内A的反应速率为0.3mol·L-1·min-1
D. 若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 人们最早先根据味道来获得朴素的酸、碱概念:一切有酸味的物质都是酸,一切有涩味的物质都是碱。
B. 波义耳基于指示剂变色来分辨酸碱:酸一定能使石蕊变红,碱一定能使石蕊变蓝。
C. 地球上最大规模的化学反应是植物的光合作用,人类利用氮肥的最有效的反应是合成氨反应。
D. 酸碱质子理论:凡是能给出![]() 的物质就是酸,凡是能结合
的物质就是酸,凡是能结合![]() 的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com