
【题目】![]() 的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集
的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集![]() 的体积在相同状况下分别为
的体积在相同状况下分别为![]() 和
和![]() ,若
,若![]() ,下列说法正确的是
,下列说法正确的是![]()
A.HX可能是强酸
B.NaX水溶液的碱性弱于NaY水溶液的碱性
C.HX一定是弱酸
D.反应过程中二者生成H2的速率相同
【答案】C
【解析】
A.pH=2的两种一元酸HX与HY溶液,分别与足量Mg反应,HX产生氢气多,则HX为弱酸,故A错误;
B.因为酸性:![]() ,根据越弱越水解的原理,相同浓度的NaX,NaY溶液,NaX碱性强,故B错误;
,根据越弱越水解的原理,相同浓度的NaX,NaY溶液,NaX碱性强,故B错误;
C.![]() 的两种一元酸,分别取50mL加入足量镁粉,由
的两种一元酸,分别取50mL加入足量镁粉,由![]() ,说明HX溶液的浓度较大,则HX酸性较弱,HX一定是弱酸,故C正确;
,说明HX溶液的浓度较大,则HX酸性较弱,HX一定是弱酸,故C正确;
D.反应速率与氢离子浓度成正比,两种酸pH相等,所以开始时反应速率相等,因为HX为弱酸,随着反应的进行,电离平衡不断向电离方向移动,电离出氢离子,所以HX溶液中的氢离子浓度大于HY里的氢离子浓度,所以反应过程中HX反应速率快,故D错误;
答案:C。


科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。下列有关说法正确的是
已知:Ksp(ZnS)=3×10-25
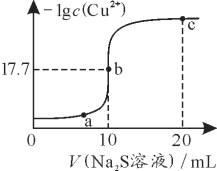
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
B. a、b、c三点对应的溶液中,水的电离程度最大的为b点
C. 该温度下,Ksp(CuS)=1×10-35.4
D. 向100 mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在下坡时,电池处于充电状态。
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理如图1所示,其总反应式为H2+2NiOOH![]() 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH___ (填“增大”、“减小”或“不变”),该电极的电极反应式为___。
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH___ (填“增大”、“减小”或“不变”),该电极的电极反应式为___。
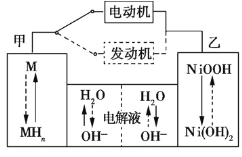
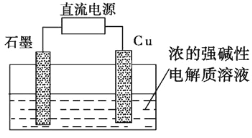
图1 图2
(2)Cu2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应式为2Cu+H2O![]() Cu2O+H2↑,阴极的电极反应式是________。用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为___g。
Cu2O+H2↑,阴极的电极反应式是________。用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物说法正确的是( )
A. 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯
B. ![]() 是由单体CH2=CH—CH3和CH2=CH2发生加聚反应的产物
是由单体CH2=CH—CH3和CH2=CH2发生加聚反应的产物
C. 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程
D. 淀粉与纤维素互为同分异构体,二者水解的最终产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
B.聚合物![]() 不是纯净物
不是纯净物
C.相对分子质量为72的某烷烃,一氯代物有4种
D.植物油氢化、塑料和橡胶的老化过程中均发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
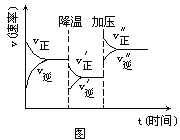
A.A、B、C、D均为气体
B.若A、B是气体,则C、D是液体或固体
C.逆反应是放热反应
D.在整个过程中,A的转化率一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法不正确的是![]()
A.用硝酸银溶液检验KI溶液与过量的![]() 溶液反应后有在
溶液反应后有在![]() ,说明该反应存在限度
,说明该反应存在限度
B.可以用饱和NaCl溶液除去![]() 中的少量HCl气体
中的少量HCl气体
C.锌与稀硫酸反应制![]() 时,滴加几滴硫酸铜溶液,可以加快反应速率
时,滴加几滴硫酸铜溶液,可以加快反应速率
D.用稀硫酸可以鉴別亚硫酸钠、碳酸钠和硅酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:![]() 。放电时,正极的电极反应式为 ______ ,充电时,该电极应与电源的 ______
。放电时,正极的电极反应式为 ______ ,充电时,该电极应与电源的 ______ ![]() 填“正”或“负”
填“正”或“负”![]() 极相连.
极相连.
(2)氨在氧气中燃烧,生成水和氮气。已知:![]() ;
;![]() ,
,![]() ;
;![]() ,则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为: ______ 。
,则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为: ______ 。
(3)研究表明工业上合成氨反应![]() 在
在![]() 、
、![]() 的平衡常数分别为
的平衡常数分别为![]() 和200。
和200。
①合成氨是 ______ 反应![]() 填“放热”或“吸热”
填“放热”或“吸热”![]() 。
。
②合成氨选择![]() 的原因是: ______ 。
的原因是: ______ 。
③在容积固定的密闭容器中发生上述反应,如表中为各物质在不同时刻的浓度:
时间 |
|
|
|
0 |
|
| 0 |
5 |
| X |
|
10 |
|
|
|
![]() ,
,![]() 的平均反应速率
的平均反应速率![]() ______。反应在5分钟时,条件发生了改变,改变的条件可能是 ______
______。反应在5分钟时,条件发生了改变,改变的条件可能是 ______ ![]() 填序号
填序号![]() 。
。
![]() 使用催化剂
使用催化剂 ![]() 降低温度
降低温度 ![]() 增加氢气的浓度
增加氢气的浓度 ![]() 分离出
分离出![]()
(4)在![]() 时,液氨中存在电离平衡
时,液氨中存在电离平衡![]() ,离子积常数
,离子积常数![]() 。若一定条件下,平衡时
。若一定条件下,平衡时![]()
![]() ,下列说法正确的是 ______ 。
,下列说法正确的是 ______ 。
![]() ,液氨的离子积常数增大
,液氨的离子积常数增大
![]() 此温度下液氨的离子积常数为
此温度下液氨的离子积常数为![]()
![]() 液氨在
液氨在![]() 的电离程度比常温下纯水的大
的电离程度比常温下纯水的大
(5)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:![]() ,下列叙述正确的是 ______
,下列叙述正确的是 ______ ![]() 填字母
填字母![]() 。
。
A. 放电时负极反应为:![]()
B. 充电时阳极反应为:![]()
C. 放电时每转移3mol电子,正极有![]() 被氧化。
被氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定环境中一定能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3、SO42、Na+
B.存在较多Fe3+的溶液中:Na+、SCN、CO32、K+
C.常温下水电离出的c(H+)=10-12mol/L的溶液中::NH4+、Cl、CO32、F
D.在能使红色石蕊试纸变蓝色的溶液中:Na+、CO32、S2、NO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com