
【题目】下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
A.空气、天然气、苛性钾、石灰石B.液氯、氯水、硫酸钠、乙醇
C.盐酸、水煤气、醋酸、干冰D.胆矾、漂白粉、氯化钾、氯气
科目:高中化学 来源: 题型:
【题目】五种元素的原子电子层结构如下:
A.1s22s22p63s23p63d54s1;B.1s22s22p63s2;C.1s22s22p6;D.1s22s22p63s23p;E.[Ar]4s1。试回答:
(1)哪个式子是错误的________,它违背了________。
(2)哪个式子表示稀有气体原子________。
(3)A的元素符号是________,写出其价电子排布的轨道表示式________。
(4)B和E的金属性强弱关系为________(用元素符号表示),可以说明这一事实的依据是(写出2点)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
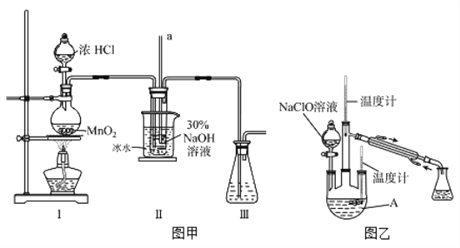
(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
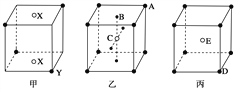
【题目】如下图所示的甲、乙、丙三种晶体:
试写出:
(1)甲晶体的化学式(X为阳离子)为________。
(2)乙晶体中A、B、C三种粒子的个数比是________。
(3)丙晶体中每个D周围结合E的个数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所表示的方法研究金属钠与水反应的性质,其中A是用带孔的铝箔包着的小块的金属钠.

(1)从大块钠上取下的小块钠要用滤纸擦一擦,这样做的目的是_______________。
(2)包裹钠块的铝箔要预先扎上足够多的小孔,若孔数不够,可能出现的不良后果是__________.假如在实验刚开始就将镊子松开拿出水面,A表现出的现象是 _______________________,出现这种现象的原因是______________。
(3)据预测,钠与水反应生成氢气和氢氧化钠.
证明生成氢氧化钠的实验方法和相应的现象是______________________;
(4)已知反应结束后铝箔和钠均消失,请写出相关反应的离子方程式:______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)计算下列分子或离子中带点“·”原子的价电子对数。
①CCl4________;②BeCl2________;③BCl3________;④PCl3________。
(2)计算下列微粒中带点“·”原子的孤电子对数。
①H2S ________;②PCl5________;③BF3________;④NH3________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
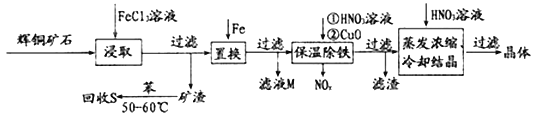
(1)“浸取”时,为了提高浸取速率可采取的措施有___________________________(任写一点)。写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:_____________________________________。
(2)“保温除铁”过程中,加入CuO的目的是_________________________________________;“蒸发浓缩、冷却结晶”过程中,加入HNO3调节溶液的pH,其理由是____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________________。向“滤液M”中加入(或通入)_____ (填字母),可得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)“回收S”过程中温度控制在50 ~60℃之间,不宜过高或过低的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管 D 的质量为 86.4g;
③准确称得 6g 纯碱样品放入容器 b 中;
④打开分液漏斗 a 的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管 A 中缓缓鼓入空气数分钟,然后称得干燥管 D 的总质量为 88.6g。 试回答:
(1)鼓入空气的目的是_____,装置 A 中试剂 X 应选用_____;
(2)若④、⑤两步的实验操作太快,则会导致测定结果_____(填“偏大”或“偏小”)
(3)若没有 C 装置,则会导致测定结果_____(填“偏大”或“偏小”)
(4)根据实验中测得的有关数据,计算出纯碱样品 Na2CO3 的质量分数为_____;
(5)本实验设计是否存在问题_____(填“是”或“否”),若存在,改进措施为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com