
【题目】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:

(1)已知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) ![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
请写出反应I的热化学方程式__________________________________________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO平衡转化率见下图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。
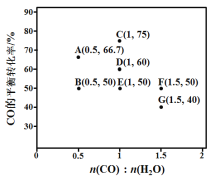
①经分析,A、E和G三点对应的反应温度相同,其原因是KA=KE=KG=__________(填数值)。在该温度下:要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是_____
②对比分析B、E、F三点,可得出对应的进气比和反应温度的变化趋势之间的关系是________
③比较A、B两点对应的反应速率大小:VA________VB(填“<” “=”或“>”)。反应速率v=v正v逆= K正X(CO)![]() X(H2O) –K逆X( CO2)
X(H2O) –K逆X( CO2)![]() X(H2),K正、K逆分别为反应速率常数,X为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
X(H2),K正、K逆分别为反应速率常数,X为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
![]() =__________ (计算结果保留1位小数)。
=__________ (计算结果保留1位小数)。
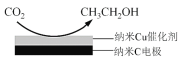
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。
①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中 =________(列出计算式)。
=________(列出计算式)。
②在饱和KHCO3电解液中电解CO2来制备乙醇的原理如图所示。则阴极的电极反应式是________。
【答案】CH3CH2OH(g)+H2O(g) ![]() 4H2(g)+2CO(g) △H= +256.1 kJ/mol 1 及时移去产物 进气比越大,反应温度越低或进气比越小,反应温度越高 < 36.0 c-a 14CO2+12e-+9H2O=CH3CH2OH+12HCO3-
4H2(g)+2CO(g) △H= +256.1 kJ/mol 1 及时移去产物 进气比越大,反应温度越低或进气比越小,反应温度越高 < 36.0 c-a 14CO2+12e-+9H2O=CH3CH2OH+12HCO3-
【解析】
(1)结合图1和已知的两个热化学方程式方程式,确定反应I的热化学方程式;
(2)①CO(g)+H2O(g) ![]() CO2(g)+H2(g)该反应是反应前后气体分子数不变的反应,E点时n(CO):n(H2O)=1,CO平衡转化率为50%,假设开始时CO、H2O的物质的量均为xmol,计算平衡时n(CO)、n(H2O)、n(CO2)、n(H2)然后进行相关计算;
CO2(g)+H2(g)该反应是反应前后气体分子数不变的反应,E点时n(CO):n(H2O)=1,CO平衡转化率为50%,假设开始时CO、H2O的物质的量均为xmol,计算平衡时n(CO)、n(H2O)、n(CO2)、n(H2)然后进行相关计算;
②CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol 该反应是放热反应,当其他条件不变时,温度越高转化率越低;
CO2(g)+H2(g) △H1= - 41 kJ/mol 该反应是放热反应,当其他条件不变时,温度越高转化率越低;
③A、E和G三点对应的反应温度相同,B的温度比E的温度高,投料比相同时,温度越高反应速率越快;先计算出D点平衡时K正、K逆的关系,然后计算出反应过程中当CO的转化率为20%,然后计算出CO、H2O、CO2、H2的物质的量分数;
(3)①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,c(H+)=1.0×10-cmol/L,  =
= ;
;
②电解时,阴极发生还原反应,CO2得电子转化为CH3CH2OH。
(1)①CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol ②CH3CH2OH(g)+3H2O(g)
CO2(g)+H2(g) △H1= - 41 kJ/mol ②CH3CH2OH(g)+3H2O(g)![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol,根据盖斯定律可知:由①×2+②得CH3CH2OH(g)+H2O(g)
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol,根据盖斯定律可知:由①×2+②得CH3CH2OH(g)+H2O(g)![]() 4H2(g)+2CO(g) △H= +256.1 kJ/mol ;
4H2(g)+2CO(g) △H= +256.1 kJ/mol ;
(2)①A、E和G三点对应的反应温度相同,平衡常数相同,E点时n(CO):n(H2O)=1,CO平衡转化率为50%,假设开始时CO、H2O的物质的量均为xmol,平衡后n(CO)=n(H2O)=n(CO2)=n(H2)=0.5mol,同一容器中,所以平衡后c(CO)=c(H2O)=c(CO2)=c(H2),KE=![]() =1,故KA=KE=KG=1;在该温度下:要提高CO平衡转化率,在CO的物质的量不变的情况下,继续通入过量的H2或减小生成物的浓度,即及时移去生成物;
=1,故KA=KE=KG=1;在该温度下:要提高CO平衡转化率,在CO的物质的量不变的情况下,继续通入过量的H2或减小生成物的浓度,即及时移去生成物;
②CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol,B、E、F三点,n(CO):n(H2O)的比值逐渐增大,但是它们的转化率不变,说明它们的温度越低,即进气比越大,反应温度越低;
CO2(g)+H2(g) △H1= - 41 kJ/mol,B、E、F三点,n(CO):n(H2O)的比值逐渐增大,但是它们的转化率不变,说明它们的温度越低,即进气比越大,反应温度越低;
③因为A、E和G三点对应的反应度相同,由②可知B的温度比E的温度高,投料比相同时,温度越高反应速率越快,故VA< VB;D点的时,n(CO):n(H2O)=1,假设开始时CO、H2O的物质的量均为ymol,反应过程中当CO的转化率为20%,n(CO)=n(H2O)=0.8ymol,n(CO2)=n(H2)=0.2ymol,X(CO)=X(H2O)=![]() =40%,X(CO2)=X(H2)=
=40%,X(CO2)=X(H2)=![]() =10%;D点的时,CO平衡转化率为50%,故平衡时n平(CO)=n平(H2O)=0.4ymol,n平(CO2)=n平(H2)=0.6ymol,X平(CO)=X平(H2O)=
=10%;D点的时,CO平衡转化率为50%,故平衡时n平(CO)=n平(H2O)=0.4ymol,n平(CO2)=n平(H2)=0.6ymol,X平(CO)=X平(H2O)= ![]() =20%,X平(CO2)=X平(H2)=
=20%,X平(CO2)=X平(H2)= ![]() = 30%,平衡时v正=v逆,即K正X(CO)
= 30%,平衡时v正=v逆,即K正X(CO)![]() X(H2O)=K逆X( CO2)
X(H2O)=K逆X( CO2)![]() X(H2),故
X(H2),故![]() =
=![]() =
=![]() ,故在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时,
,故在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时,![]() =
=![]() =
=![]() =36.0;
=36.0;
(3)①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,c(H+)=1.0×10-cmol/L, =
= =c-a;
=c-a;
②电解时,阴极发生还原反应,CO2得电子转化为CH3CH2OH,阴极电极反应式为14CO2+12e-+9H2O=CH3CH2OH+12HCO3-。


科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法不正确的是(NA 为阿伏加德罗常数的值) ( )
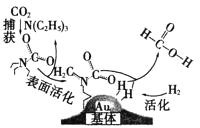
A.10.1gN(C2H5)3 中所含的共价键数目为 2.1NA
B.标准状况下,22.4LCO2 中所含的电子数目为 22NA
C.在捕获过程中,二氧化碳分子中的共价键完全断裂
D.100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质只含C、H、O三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
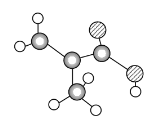
(1)该物质中含氧官能团的结构简式为________。
(2)下列物质中,与该物质互为同分异构体的是________(填序号)。
A.CH3CH2CH2COOH
B.OHCCH(CH3)CHO
C.CH3CH2CH===CHCOOH
D.CH2===CHCOOCH3
(3)该分子中共平面的原子数最多为________(已知羧基的四个原子可以共平面)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
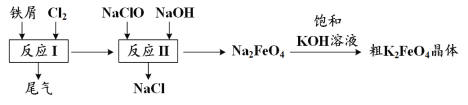
下列叙述错误的是
A.用K2FeO4作水处理剂时,既能杀菌消毒又能净化水
B.反应I中尾气可用FeCl2溶液吸收再利用
C.反应II中氧化剂与还原剂的物质的量之比为3:2
D.该条件下,物质的溶解性:Na2 FeO4< K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生的污染。其工作原理如图所示。下列说法正确的是
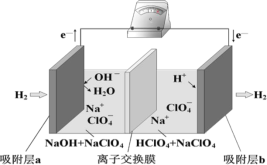
A.“全氢电池”工作时,将酸碱反应的中和能转化为电能
B.吸附层 b 发生的电极反应:H2 – 2 e+ 2OH= 2H2O
C.NaClO4 的作用是传导离子和参与电极反应
D.“全氢电池”的总反应: 2H2 + O2 =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以石油裂解气E为原料,通过下列化学反应制取1,3-丙二醇。
![]()
已知E能使酸性高锰酸钾溶液退色;同温同压下,E的密度是H2的21倍;E分子中有3种不同化学环境的氢原子,其个数比为1∶2∶3。下列关于E的叙述不正确的
A. E的相对分子质量为42
B. E的结构简式为CH2=CHCH3
C. E分子中所有的碳原子在同一平面上
D. 反应①是将E通入溴的四氯化碳溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几百年前,著名化学家波义耳发现了铁盐与没食子酸(结构简式为 )之间的显色反应,并由此发明了蓝黑墨水。
)之间的显色反应,并由此发明了蓝黑墨水。
(1)没食子酸的分子式为__,所含官能团的名称为__。
(2)用没食子酸制造墨水主要利用了__(填序号)类化合物的性质。
A.醇 B.酚 C.油脂 D.羧酸
(3)下列试剂与没食子酸混合后不能很快反应的是__(填序号)。
A.酸性KMnO4溶液 B.浓溴水 C.乙醇
(4)假设没食子酸的合成途径如下:

A的结构简式为__,①的反应类型为_;反应②的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质谱图显示,某化合物的相对分子质量为74;燃烧实验发现,该化合物分子内碳、氢原子个数之比为2∶5;核磁共振氢谱显示,该化合物分子中只有两种类型的氢原子。下列关于该化合物的叙述不正确的是( )
A.该化合物可能为![]() 甲基
甲基![]() 丙醇B.该化合物为
丙醇B.该化合物为![]() 丁醇的同分异构体
丁醇的同分异构体
C.该化合物可能为乙醚D.该化合物为乙醚的同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com