
【题目】如图所示,a、b是两根石墨棒。下列叙述正确的是( )
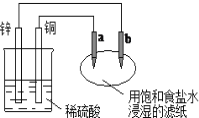
A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.往滤纸上滴加酚酞试液,a极附近颜色变红
D.稀硫酸中硫酸根离子的物质的量不变
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】现将1.92gCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL的NOX混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的O2的体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓) ![]() CuSO4+X↑+2H2O试通过计算和推理回答下面的问题:
CuSO4+X↑+2H2O试通过计算和推理回答下面的问题:
(1)X物质可以导致酸雨的形成,X应该属于________(填字母代号)。
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)X物质可以使酸性KMnO4溶液褪色,该过程中(填化学式,下同)______失去电子,氧化剂是______。
(3)足量的铜片与20mL18mol·L-1的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为______mol,生成的X气体在标准状况下体积为______L(假设气体全部逸出)。
(4)将(3)反应后得到的溶液与过量Ba(OH)2溶液混合,充分反应,反应后所得沉淀的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国斯坦福大学的工程师设计出一种从污水“提取”潜在电能的新型微生物电池,该电池能将生活污水中的有机物分解同时发电,电池结构如图所示。已知a电极为惰性材料,b电极为Ag2O。下列说法不正确的是( )
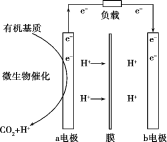
A.a电极是负极,b电极是正极
B.b电极发生的反应是Ag2O+2e-+2H+=2Ag+H2O
C.a电极每生成标准状况下2.24LCO2,可向b电极转移0.1mol电子
D.高温条件下,该电池不能正常工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)t1℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为___。
②5~6min时间段内,平衡移动方向为___(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是___(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度
c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度___c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:

①用CO还原FeO制备Fe的反应是___(填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2___T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图2所示。
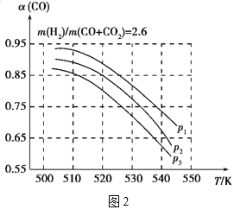
图中的压强由大到小的顺序为___,判断理由是___;试解释CO平衡转化率随温度升高而减小的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离的c(H+)=10-13 mol/L 的溶液中:Na+、K+、![]() 、
、![]()
B.pH=7的溶液中:Na+、Fe3+、Cl-、![]()
C.常温下的溶液中:Cl-、Al3+、Na+、![]()
D.c(H+)=1×10-12mol/L的溶液中:K+、ClO-、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用滤纸折成一个纸蝴蝶,并喷洒一种溶液(保持湿润),挂在铁架台上,将盛某种溶液的烧杯放在纸蝴蝶的下方,如图所示。向烧杯中加入另一种物质,过一会儿发现纸蝴蝶变为红色且保持红色不变,下面的组合能够实现上述变化的是( )
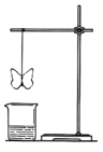
A | B | C | D | |
纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
烧杯中的溶液 | 浓硫酸 | 氯化铵 | 稀硫酸 | 高锰酸钾 |
加入烧杯中的物质 | 铜 | 氢氧化钠浓溶液 | 氨水 | 浓盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为18.4 mol/L的浓硫酸来配制 500 mL0.46 mol/L的稀硫酸,可供选择的仪器有:①玻璃棒②烧杯③胶头滴管④量筒⑤容量瓶⑥托盘天平⑦药匙
(1)上述仪器中,配制过程中用不到的有________。
(2)计算所需浓硫酸的体积为_________mL。
(3)在配制过程中,下列操作可引起所配溶液浓度偏高的有_________。(填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到定量瓶中
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容时,俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com