
已知3.2 g某气体的分子数目为3.01×1022,由此可推知该气体的摩尔质量是
A. 64 g B. 32 g·mol-1 C. 32 g D. 64 g·mol-1
科目:高中化学 来源: 题型:
将甲、乙两种金属的性质相比较,能说明甲的金属性比乙强的是( )
① 甲跟水反应比乙与水反应剧烈
② 甲单质能从乙的盐溶液中置换出单质乙
③ 甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④ 与某金属反应时甲原子得电子数目比乙的多
A.①④ B.①③ C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如下,选项中关于橙花醇的叙述,错误的是
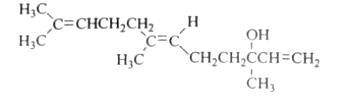
A.橙花醇的分子式C15H26O
B.橙花醇在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
C.橙花醇既能发生取代反应,也能发生加成反应和氧化反应
D.1mol 橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240 g溴
查看答案和解析>>
科目:高中化学 来源: 题型:
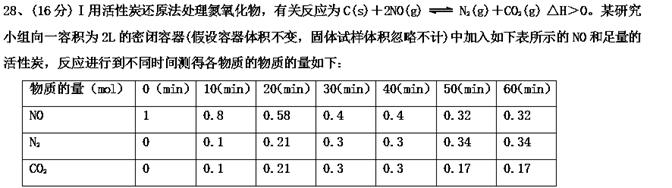 (1)10 min~20 min以v(CO2)表示的反应速率为________ mol·L-1·s-1。
(1)10 min~20 min以v(CO2)表示的反应速率为________ mol·L-1·s-1。
(2) 在10min和40min这两个时间分别改变了一个条件,则10min时改变的条件可能是________(填选项字母)。
A.升高温度 B.降低温度 C.加入催化剂
D.增加N2的浓度 E.减小NO的浓度 F.减小CO2的浓度
(3) 一定温度下,随着NO的起始浓度增大,则NO的平衡转化率________(填“增大”、“不变”或“减小”)。
Ⅱ臭氧是一种在生产生活中有着广泛运用的化学物质,可以用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。目前常用的人工制备臭氧的方法有:电晕放电法、电化学法、紫外线法等。其中电化学法因其设备简易,使用维修简单、安全,生成臭氧成分纯净等特点而得到广泛运用。某课外小组运用下图装置以PbO2做阳极,Pt电极为阴极电解饱和K2SO4溶液制备O3 ,并采用碘量法测定臭氧的产率。(已知电解时在阳极可能有生成O2的副反应发生,碘量法测定的过程中不考虑O2和KI反应 )

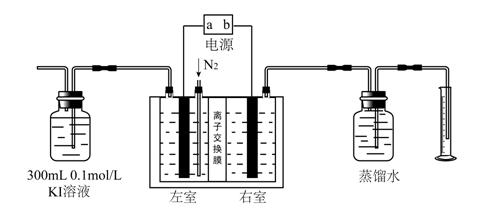
实验过程如下:
①按上图连接好装置,检查气密性后接通电源开始进行反应。
②电解的过程中以1.5L/min的速率鼓入N2 ,使产生的O3能够完全被KI溶液吸收,反应后有O2生成(不考虑该过程中溶液体积变化)。
③电解20 min后,通过量筒测得右室中产生的气体体积为224 ml(已转化为标准状况)。
④将充分吸收了O3的300ml KI溶液取出30.00 ml,加入2滴0.1mol/L的淀粉溶液作指示剂,用0.01mol/L的Na2S2O3溶液进行滴定。测得消耗Na2S2O3溶液的体积为31.00ml。(已知反应的化学方程式为:I2 + 2Na2S2O3 = Na2S4O6 + 2NaI )
(1)右室产生的气体为 (填化学式),写出左室发生的电极反应方程式 。
(2)写出KI溶液吸收O3的化学方程式 。
(3)该实验过程中鼓入N2的速率不能过快,若鼓入太快测定出臭氧的产率将偏 (填“大”或“小”),根据实验所得数据,该装置产生臭氧的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体的叙述中,不正确的是
A.不同的气体,若体积不同,则它们所含的分子数肯定不同
B.在标准状况下,气体的摩尔体积约为22.4 L·mol-1
C.当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离
D.气态物质没有固定的形状,且容易被压缩
查看答案和解析>>
科目:高中化学 来源: 题型:
200 mL 0.3 mol·L-1的K2SO4溶液和100 mL 0.2 mol·L-1的Fe2(SO4)3溶液混合后,若忽略液体混合时体积的变化,则溶液中SO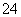 的物质的量浓度为
的物质的量浓度为
A.0.3 mol·L-1 B.0.4 mol·L-1 C.0.45 mol·L-1 D.0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol。求:
(1)原NaOH溶液的质量分数。
(2)所得溶液中Cl-的物质的量。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,甲容器中的NH3和乙容器中的CH4所含的原子总数相同,则甲容器与乙容器的体积之比为 ( )
A.1:1 B.2:1 C.3:4 D.5:4
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)元素的第一电离能:Al________Si(填“>”或“<”)。
(2)基态Mn2+的核外电子排布式为________。
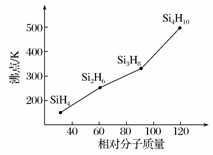
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是_________________________________。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
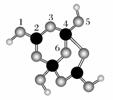
①在Xm-中,硼原子轨道的杂化类型有________;配位键存在于________原子之间(填原子的数字标号);
m=________(填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有________ (填序号)。
A.离子键 B.共价键 C.金属键
D.范德华力 E.氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com