
| A、福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 |
| B、“低能耗、低污染、低排放”是低碳经济的重要标志,其中“低排放”主要是指减少二氧化碳排放 |
| C、为证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
| D、除去SO2中混有的少量HCl气体,可将气体通过盛有足量饱和NaHSO3溶液的洗气瓶 |


科目:高中化学 来源: 题型:
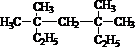 系统命名为
系统命名为查看答案和解析>>
科目:高中化学 来源: 题型:
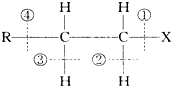 中化学键的叙述中,下列说法不正确的是( )
中化学键的叙述中,下列说法不正确的是( )| A、当该卤代烃发生取代反应时,被破坏的键是①和② |
| B、当该卤代烃发生消去反应时,被破坏的键是①和③ |
| C、当该卤代烃在碱性条件下发生水解反应时被破坏的键是① |
| D、当该卤代烃发生消去反应时,被破坏的键是①和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性HClO4>H2SO4>H3PO4>H2CO3 |
| B、稳定性H2S>HCl>HBr>HI |
| C、粒子半径Br->K+>S2->S |
| D、还原性Na>Br->Cl->S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V正(B2)═V逆(AB2) |
| B、容器内的总压强不随时间而变化 |
| C、单位时间内生成1molAB2的同时,消耗1mol的B2 |
| D、各成分的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa+含有质子数为10NA |
| B、标况下,2.24升CCl4物质的量为0.1mol |
| C、标准状况下,分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
| D、5.6g金属铁与足量盐酸反应时,失去0.3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Na+的结构示意图 |
| B、纯碱的化学式为Na2CO3 |
C、溴化铵的电子式: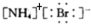 |
| D、高氯酸(HClO4)中氯元素的化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)随温度的升高而增大 |
| B、水的电离过程是放热的 |
| C、水的电离平衡常数与浓度、温度有关 |
| D、在35℃时,c(H+)>c(OH─) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com