
����Ŀ������A��B��C��D��E��F���ֶ�����Ԫ�أ�����B��C��D��E����Ԫ���ڻ�ѧ��Ӧ�о����γɼ����������ӣ���B��C��D���Ӿ�����ͬ�ĵ��Ӳ�ṹ����֪��
��A���γ�������������Ԫ�أ�F��Aͬ���壻
��C���⻯�����G�Ǿ���10���ӵ������ҿ��Է�����ͼת����
![]()
��E��D��ͬ����Ԫ�أ�
��B��D���γɸ�����Ϊ1��1��2��1�����ӻ�����X��Y��
��ش��������⣺
(1)B��D�γ����ӻ�����Y����Ư���ԣ�д��Y�ĵ���ʽ______���û������Ԫ��A�����������O��Ӧ�Ļ�ѧ����ʽΪ��__________��һ������Y��O��Ӧ��õ��Ĺ������ʣ���ǡ���뺬400 mL 2 mol/L��ϡ���ᷴӦ�����ռ���0.25 mol���壬��ù������ʵ����Ϊ________�������ʵ�����ʾ����
(2)G����ļ��鷽��Ϊ_________��13.44 L����G(��״���²ⶨ��������ͼת����ʽ���Ի��M���ʵ����ֱ�Ϊ__________mol��
(3)ij��ѧ��ȤС����������ͼװ��֤��A��C��F����Ԫ�����ʵĵݱ��ԣ����м�װ������ƿ�������Լ�Ϊʯ��ʯ��
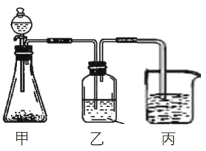
�ټ�װ���з�����Ӧ�����ӷ���ʽΪ________________��
����װ����Ӧ���ӵ��Լ�Ϊ______________��
�۱�װ���п��ܷ�����ʵ������Ϊ___________________________��
���𰸡� ![]() 2Na2O2+2CO2=2Na2CO3+O2 0.1mol̼���ƺ�0.3mol�������� ��ʪ��ĺ�ɫʯ����ֽ�������壬����ֽ����˵���а������ڣ�����պ��Ũ����IJ������������壬������������˵���а������ڣ� 0.4 CaCO3+2H+= Ca2++ H2O+CO2�� ����NaHCO3��Һ ������ɫ��״����
2Na2O2+2CO2=2Na2CO3+O2 0.1mol̼���ƺ�0.3mol�������� ��ʪ��ĺ�ɫʯ����ֽ�������壬����ֽ����˵���а������ڣ�����պ��Ũ����IJ������������壬������������˵���а������ڣ� 0.4 CaCO3+2H+= Ca2++ H2O+CO2�� ����NaHCO3��Һ ������ɫ��״����
������������Ԫ�ص��ƶ��Լ��ǽ�����ǿ���ıȽϣ���A���γ�������������Ԫ�أ���AΪC��F��Aͬ���壬��FΪSi����B��D�γɸ�����Ϊ1��1��2��1�����ӻ������ΪNa2O2��Na2O�����BΪNa��DΪO������ΪB��C��D���γɵ����Ӿ�����ͬ���Ӳ�ṹ����BΪNa�������ӷ���ΪNa����C���⻯�����G�Ǿ���10��������Ҳ�ܷ�����Ŀ������ת����ϵ����CΪN����E��Dͬ����Ԫ�أ���EΪS����1���γɵĻ��������Ư���ԣ���ΪNa2O2�������ʽΪ ![]() ��Na2O2��CO2�ķ�Ӧ���䷴Ӧ����ʽΪ2Na2O2��2CO2=2Na2CO3��O2��Na2O2��CO2��Ӧ�õ��������ʿ�����Na2CO3��Ҳ������Na2CO3.Na2O2������ȫ����Na2CO3������Na2CO3��2HCl=2NaCl��CO2����2H2O��������ĵ�HCl���ʵ���Ϊ0.25��2mol=0.5mol<400��10��3��2mol=0.8mol������������ǡ����ȫ��Ӧ����˹���Ӧ��Na2CO3.Na2O2����Na2O2�����ʵ���xmol��Na2CO3�����ʵ���Ϊymol������Ԫ���غ����У�2x��2y=400��10��3��2�����ݲ��������壬�ó�x/2��2y=0.25���ǵ�x=0.3mol��yΪ0.1mol����2��GΪNH3�����鰱���ķ����ǣ���ʪ��ĺ�ɫʯ����ֽ�������壬����ֽ����˵���а������ڣ�����պ��Ũ����IJ������������壬������������˵���а������ڣ���4NH3��5O2
��Na2O2��CO2�ķ�Ӧ���䷴Ӧ����ʽΪ2Na2O2��2CO2=2Na2CO3��O2��Na2O2��CO2��Ӧ�õ��������ʿ�����Na2CO3��Ҳ������Na2CO3.Na2O2������ȫ����Na2CO3������Na2CO3��2HCl=2NaCl��CO2����2H2O��������ĵ�HCl���ʵ���Ϊ0.25��2mol=0.5mol<400��10��3��2mol=0.8mol������������ǡ����ȫ��Ӧ����˹���Ӧ��Na2CO3.Na2O2����Na2O2�����ʵ���xmol��Na2CO3�����ʵ���Ϊymol������Ԫ���غ����У�2x��2y=400��10��3��2�����ݲ��������壬�ó�x/2��2y=0.25���ǵ�x=0.3mol��yΪ0.1mol����2��GΪNH3�����鰱���ķ����ǣ���ʪ��ĺ�ɫʯ����ֽ�������壬����ֽ����˵���а������ڣ�����պ��Ũ����IJ������������壬������������˵���а������ڣ���4NH3��5O2 ![]() 4NO��6H2O��2NO��O2=2NO2��3NO2��H2O=2HNO3��NO��������ϵʽΪ��4NH3��4NO��4NO2��8/3HNO3����˲�����������ʵ���Ϊ13.44��8/(22.4��3��4)mol=0.4mol����3���Ƚ�C��N��Si�ķǽ����ԣ�һ����õ��DZȽ���������������ˮ��������ԣ����з�Һ©����ʢ�����ᣬ��װ���з����ķ�Ӧ��CaCO3��2H��=Ca2����CO2����H2O����װ���ҵ������dz�ȥCO2�л���HNO3�����װ������ʢ�ŵı���̼��������Һ����̼�������ǿ�ڹ��ᣬ����Na2SiO3��CO2��H2O=H2SiO3����Na2CO3���а�ɫ��״����������
4NO��6H2O��2NO��O2=2NO2��3NO2��H2O=2HNO3��NO��������ϵʽΪ��4NH3��4NO��4NO2��8/3HNO3����˲�����������ʵ���Ϊ13.44��8/(22.4��3��4)mol=0.4mol����3���Ƚ�C��N��Si�ķǽ����ԣ�һ����õ��DZȽ���������������ˮ��������ԣ����з�Һ©����ʢ�����ᣬ��װ���з����ķ�Ӧ��CaCO3��2H��=Ca2����CO2����H2O����װ���ҵ������dz�ȥCO2�л���HNO3�����װ������ʢ�ŵı���̼��������Һ����̼�������ǿ�ڹ��ᣬ����Na2SiO3��CO2��H2O=H2SiO3����Na2CO3���а�ɫ��״����������


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ 3.6 g ̼�� 6.4 g ��������ȼ�գ�����Ӧ��ľ������ų� X kJ ��������֪���� C(s)��ȼ������ֵΪ Y kJ��mol��1���� 1 mol C(s)�� O2(g)��Ӧ���� CO(g)�ķ�Ӧ�� ��H Ϊ�� ��
A. -Y kJ/mol B. -(10X��Y) kJ/mol C. -(5X��0.5Y) kJ/mol D. +(10X��Y) kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ�У�PΪһ�����ɻ����Ļ������ر�K���ֱ�������A��B�и�����1 mol X��1 mol Y����ʼʱ��VA��a L��VB��0.8a L����ͨ�ܵ�������Բ�����������ͬ�¶Ⱥ��д������ڵ������£��������и��Է���������Ӧ��3X��g����3Y��g��![]() 2Z��g����2W��g������ƽ��ʱ��VB��0.6a L���ش��������⣺
2Z��g����2W��g������ƽ��ʱ��VB��0.6a L���ش��������⣺
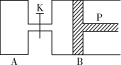
��1���ﵽƽ��ʱB��X��ת����Ϊ________________��
��2��ƽ��ʱA��B�л�������ƽ����Է��������Ĺ�ϵ�ǣ�MA____________MB������>��������������<������
��3����K��һ��ʱ���Ӧ�ٴδﵽƽ�⣬��B�����Ϊ____________L��
��������ҵ�в����ʵ��Ĵ������÷�ӦCO��g����2H2��g��![]() CH3OH��g������ȡ�״���
CH3OH��g������ȡ�״���
��4��ά����ϵ��ѹǿһ�����¶�ΪTʱ�������Ϊ2.0 L�ķ�������ڳ���0.6 mol CO��0.4 mol H2���ﵽƽ��ʱ����0.15 mol CH3OH��g������÷�Ӧƽ�ⳣ��K��________��������λС��������ʱ����������ͨ��0.7 mol CO���壬���ƽ�⽫____________���������������������������������ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA��g����B��s��![]() C��g������H��0����������������ʱ���ı�����һ��������������C�������������ӿ���������������������������
C��g������H��0����������������ʱ���ı�����һ��������������C�������������ӿ���������������������������
��1������__________��
��2����������__________��
��3�����������ݻ�__________��
��4������A__________��
��5������C__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KCl��FeCl3��Fe2(SO4)3��������ɵĻ����Һ������K��Ϊ0.15 mol��Fe3��Ϊ0.25 mol��Cl��Ϊ0.2 mol����SO42-Ϊ( )
A��0.1 mol B��0.15 mol C��0.25 mol D��0.35 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A��Һ̬�Ȼ��⡢�����Ȼ��ؾ������磬��HCl��KCl��Ϊ�ǵ����
B��SO2��SO3ˮ��Һ���ܵ��磬�ʶ��߾�Ϊ�����
C��ͭ��ʯī���ܵ��磬�������Ƕ��ǵ����
D�����ǡ��Ҵ���ˮ��Һ�к�����״̬�¶������磬���������Ƿǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij100mL���Һ�У�HNO3��H2SO4�����ʵ���Ũ�ȷֱ�Ϊ0.4mol/L��0.1mol/L����û��Һ�м���1.92gͭ�ۣ�����ʹ��Ӧ������ȫ������˵����ȷ����(���Է�Ӧǰ����Һ����仯)( )
A��������Һ��c(Cu2+)��0.225mol/L B��������Һ��c(Cu2+)��0.03mol/L
C�����������ڱ�״���µ����Ϊ0.448L D����Ӧ��ת��0.06mol�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������µĿ��淴Ӧ2SO2��O2![]() 2SO3�������ж���˵���ﵽ��ѧ��Ӧ���ȵ���
2SO3�������ж���˵���ﵽ��ѧ��Ӧ���ȵ���
A��SO2��ȫת��ΪSO3
B��SO2��O2��SO3�����ʵ���֮��Ϊ2��1��2
C����Ӧ������У�SO3�������������ٸı�
D������2 mol SO2��ͬʱ����2 mol SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����NOx�Դ�������Ⱦ����ҵ��ͨ���������·�Ӧ��NOx��NH3=N2+ H2O����������������NO2��NO�Ļ������5 L��������ͬ״����6 LNH3ǡ��ʹ����ȫת����N2������������NO2��NO�����֮��Ϊ
A. 1��4 B. 2 �� 1 C. 3��1 D. 4��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com