
【题目】某化学学习小组学习电化学后。设计了下面的实验装置图(合上电键):
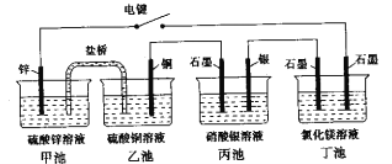
(1)电极名称,铜电极___(填写“正极”、“负极”、“阴极”、“阳极”,下同),银电极_____。
(2)丙池石墨电板上发生的电极反应式为_______,丁池中发生反应的离子方程式为_______。
(3)一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生______g固体。
【答案】 正极 阴极 ![]()
![]()
![]()
![]() 2.9
2.9
【解析】(1)合上电键后,相当于以甲池、乙池构成原电池,丙池为电镀池,丁池为电解池,活泼的金属锌变原电池的负极,则铜电极为正极;连接负极的银电极为阴极;(2)合上电键后,丙中银电极为电镀池的阴极析出银,石墨电极为阳极,电极上水电离出的氢氧根离子放电,电极反应为![]() ;丁池电解氯化镁溶液产生氢氧化镁、氢气和氯气,发生反应的离子方程式为
;丁池电解氯化镁溶液产生氢氧化镁、氢气和氯气,发生反应的离子方程式为![]()
![]()
![]() ;(3)丙中反应为2H2O+4AgNO3
;(3)丙中反应为2H2O+4AgNO3![]() 4Ag+O2↑+4HNO3,丁池中反应为MgCl2+2H2O
4Ag+O2↑+4HNO3,丁池中反应为MgCl2+2H2O![]() Cl2↑+H2↑+Mg(OH)2↓,根据电子守恒,
Cl2↑+H2↑+Mg(OH)2↓,根据电子守恒,
O2 ~4e-~2Mg(OH)2
![]() mol n
mol n
则n=0.05mol,所以氢氧化镁的质量为0.05mol×58g/mol=2.9g。


科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是
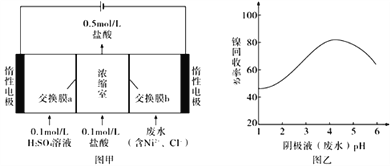
A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,甲中盛有100mL 0.1mol/LCuSO4溶液,乙中盛有100mL 0.2mol/L Na2SO4溶液。
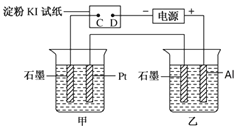
(1)通电一段时间,观察到湿润的淀粉KI试纸的_____(选填“C” 或“D”)端变蓝。
(2)装置乙中Al极的电极反应式为:_____________________。一段时间后观察到装置乙中的现象是:_________________。
(3)若电解一段时间后,装置甲中收集到气体0.056 L(标准状况下),则:装置甲中发生反应的离子反应方程式为______________________________。
(4)若电解一段时间后,装置甲中溶液需加入0.005molCu2(OH)2CO3才能恢复原来的浓度和pH,则电解过程中转移电子的物质的量为__________。
(5)某新型燃料电池,以甲醇为燃料,另一极通入一定量的CO2和O2的混合气体。一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,则负极反应式为______________。正极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验现象解释正确的是
实验内容 | 实验现象 | 相关解释 | |
A | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
C | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | 2Cu(NO3)2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大:W、X、Y、Z组成的单质可发生如图所示的化学反应;B是生活中最常见的液体;常温下Y、Z组成的二元化合物的水溶液pH=7。下列说法错误的是
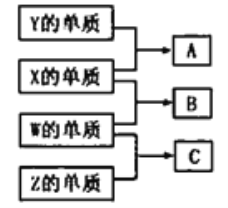
A. A与B的反应一定是化合反应
B. 离子半径:Z>X>Y>W
C. W、Y、Z均存在两种或两种以上的氧化物
D. 将等物质的量的A、C溶于同一烧杯水中,所得溶液的pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《朝闻天下》报道,河南驻马店发现特大天然碱,铅锌矿产资源。
试回答下列问题:
(1)在元素周期表中,铅与锗同主族,铅的周期数比锗大2。基态铅原子的价层电子排布式____,有_____个未成对电子。
(2)镓与锌同周期,原子序数比锌大1,锌的第一电离能大于镓的第一电离能。其原因是_____。
(3)天然碱的化学式Na2CO3·NaHCO3·2H2O。CO32-的立体构型是________;H2O中O原子采取______杂化。
(4)金是贵重金属。冶企工业上,提取企的原理是2[Au(CN)2]+ Zn=2Au+[Zn(CN)4]2-。
①与CN-互为等电子体的离子有______(任写一种); HCN分子中σ键与π键数目之比为______。
②[Zn(CN)4]2-的配体是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是_____________。
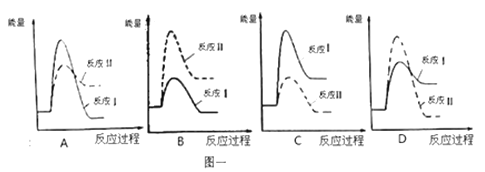
(2)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 ______________。
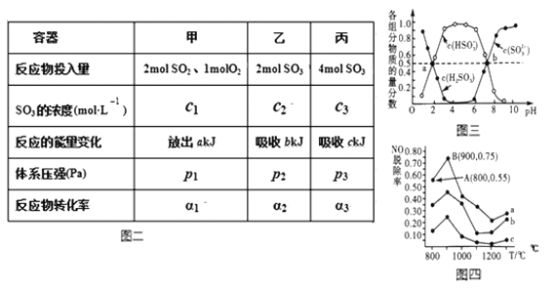
(3)在温度、容积相同且不变的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如图二(已知2SO2(g)+O2(g)=2SO3(g) △H=196.6kJ·mol-1)
A.2c1______c3 B.a+b______196.6 C.2p2______p3 D.α1+α3______1(填>,=,<)
(4) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入氨水溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图三所示。
请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___。
(5)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
①曲线c对应NH3与NO的物质的量之比是______。
② 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(6)已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9,向0.4mol/LNa2SO4的溶液中加入足量BaCO3粉末(忽略体积变化),充分搅拌,发生反应SO![]() (aq)+BaCO3 (s) BaSO4 (s)+CO
(aq)+BaCO3 (s) BaSO4 (s)+CO![]() (aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO
(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO![]() )=________mol·L-1(小数点后两位).
)=________mol·L-1(小数点后两位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下图装置实验,下列实验现象预期及相应结论均正确的是
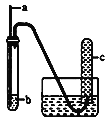
a | b | 实验现象预期 | 结论 | |
A | 铁丝 | HCl酸化的H2O2 | c中收集到无色气体 | 铁丝催化H2O2分解 |
B | 铜丝 | 浓硝酸 | c中收集到红棕色气体 | 硝酸有强氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 木条 | 浓硫酸 | 木条变黑 | 浓硫酸有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com