
ΓΨΧβΡΩΓΩΕ‘œ¬Ν– Β―ιœ÷œσΫβ Ά’ΐ»ΖΒΡ «
Β―ιΡΎ»ί | Β―ιœ÷œσ | œύΙΊΫβ Ά | |
A | Β»ΝΩΒΡCuΖ÷±π”κΒ»ΧεΜΐΉψΝΩΒΡ≈®œθΥαΚΆœΓœθΥαΖ¥”Π | ≈®œθΥαΖ¥”ΠΚσ≥ ¬Χ…ΪΘ§œΓœθΥαΖ¥”ΠΚσ≥ άΕ…Ϊ | c(Cu2+)≤ΜΆ§ |
B | NH3”κCl2ΜλΚœ | …ζ≥…ΑΉ―Χ | NH3”κCl2ΖΔ…ζΜ·ΚœΖ¥”Π…ζ≥…NH4Cl |
C | ΆυFe(OH)3ΫΚΧε÷–÷πΒΈΒΈ»κœΓ―ΈΥα | œ»≥ωœ÷ΚλΚ÷…Ϊ≥ΝΒμΘ§Κσ≥ΝΒμ»ήΫβ | œ»ΫΚΧεΨέ≥ΝΘ§ΚσFe(OH)3»ήΫβ |
D | Φ”»»œθΥαΆ≠ΙΧΧεΘ§ΫΪ¥χΜπ–«ΒΡΡΨΧθ…λ»κΥυΒΟΒΡΤχΧε÷– | …ζ≥…ΚλΉΊ…ΪΤχΧεΘ§¥χΜπ–«ΡΨΧθΗ¥»Φ | 2Cu(NO3)2 |
A. A B. B C. C D. D
ΓΨ¥πΑΗΓΩC
ΓΨΫβΈωΓΩ
AΘ°ΫΪΒ»÷ ΝΩΒΡΆ≠Τ§Ζ÷±π”κΒ»ΧεΜΐΓΔΙΐΝΩΒΡ≈®œθΥαΚΆΙΐΝΩΒΡœΓœθΥαΖ¥”ΠΚσΘ§ΥυΒΟ»ή“Κ÷–Cu2+ΒΡ≈®Ε»Μυ±ΨœύΒ»Θ§―’…ΪΜυ±ΨœύΆ§Θ§≤ΜΩ…Ρή «c(Cu2+)≈®Ε»≤ν“λ“ΐΤπΒΡΘ§»τ»ή“Κ≥ ΓΑ¬Χ…ΪΓ±Ω…Ρή «»ή“Κ÷–Cu2+”κNO2Ι≤¥φΒΡΫαΙϊΘ§Ι A¥μΈσΘΜBΘ°NH3”κCl2ΜλΚœ≥ΐΝΥ…ζ≥…¬»Μ·οßΘ§ΜΙΜα”–ΒΣΤχ…ζ≥…Θ§≤Μ τ”ΎΜ·ΚœΖ¥”ΠΘ§Ι B¥μΈσΘΜCΘ°ΆυFe(OH)3ΫΚΧε÷–÷πΒΈΒΈ»κœΓ―ΈΥαΘ§œ»ΖΔ…ζΨέ≥Νœ÷œσ…ζ≥…«β―θΜ·Χζ≥ΝΒμΘ§Μα≥ωœ÷ΚλΚ÷…Ϊ≥ΝΒμΘ§ΚσFe(OH)3”κHClΖ¥”Π…ζ≥…¬»Μ·ΧζΚΆΥ°Θ§≥ΝΒμ»ήΫβΘ§Ι C’ΐ»ΖΘΜDΘ°…ζ≥…ΚλΉΊ…ΪΤχΧε÷ΛΟς”–Εΰ―θΜ·ΒΣΘ§ΗυΨίΖ¥”Π2Cu(NO3)2![]() 2CuO+4NO2Γϋ+O2Γϋ÷–Εΰ―θΜ·ΒΣΒΡΧεΜΐΈΣ―θΤχΧεΜΐΒΡ4±ΕΘ§”κΩ’Τχ÷–ΒΣΤχΚΆ―θΤχΒΡ±»άΐœύΥΤΘ§¥χΜπ–«ΡΨΧθΗ¥»ΦΥΒΟςNO2ΕΦ”–÷ζ»Φ–‘Θ§Ι D¥μΈσΘΜΙ ―ΓCΓΘ
2CuO+4NO2Γϋ+O2Γϋ÷–Εΰ―θΜ·ΒΣΒΡΧεΜΐΈΣ―θΤχΧεΜΐΒΡ4±ΕΘ§”κΩ’Τχ÷–ΒΣΤχΚΆ―θΤχΒΡ±»άΐœύΥΤΘ§¥χΜπ–«ΡΨΧθΗ¥»ΦΥΒΟςNO2ΕΦ”–÷ζ»Φ–‘Θ§Ι D¥μΈσΘΜΙ ―ΓCΓΘ


 ≈ύ”≈»ΐΚΟ…ζœΒΝ–¥πΑΗ
≈ύ”≈»ΐΚΟ…ζœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥ΩΈΧβΉι“‘ΝρΧζΩσ…’‘ϋΘ®Κ§ Fe2O3ΓΔ Fe3O4ΓΔ Al2O3ΓΔ CaOΓΔ SiO2 Β»Θ©ΈΣ‘≠Νœ÷Τ»Γ»μ¥≈”Ο Fe2O3Θ®“Σ«σ¥ΩΕ»>99.2%Θ§ CaO Κ§ΝΩ<0.01%Θ©ΓΘΤδΙΛ“’Νς≥Χ»γœ¬(ΥυΦ”»κ ‘ΦΝΨυ…‘ΙΐΝΩ)ΘΚ
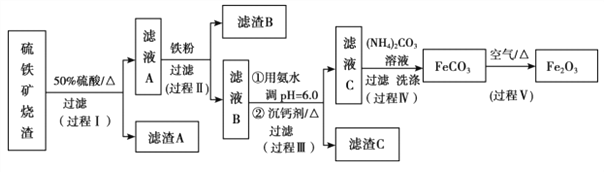
“―÷ΣΘΚ…ζ≥…«β―θΜ·ΈοΒΡ pH »γœ¬±μΥυ Ψ
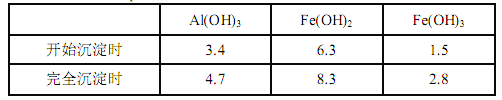
Θ®1Θ©¬Υ‘ϋ A ΒΡ÷ς“Σ≥…Ζ÷ «__________ΓΘ
Θ®2Θ©‘ΎΙΐ≥ΧΔρ÷–Ω…Ιέ≤λΒΫ≤ζ…ζ…ΌΝΩΤχ≈ίΘ§»ή“Κ―’…Ϊ¬ΐ¬ΐ±δ«≥ΓΘΡήΫβ ΆΗΟ Β―ιœ÷œσΒΡάκΉ”ΖΫ≥Χ Ϋ”–__________ΓΘ
Θ®3Θ©‘ΎΙΐ≥ΧΔρ÷–Θ§ΩΈΧβΉιΕ‘¬Υ“Κ A œΓ Ά≤ΜΆ§±Ε ΐΚσ,Φ”»κΒ»÷ ΝΩΒΡΙΐΝΩΧζΖέ,ΒΟ≥ω Fe3+≈®Ε»ΓΔΜΙ‘≠¬ ΚΆΖ¥”Π ±ΦδΒΡΙΊœΒ»γΆΦΥυ ΨΘΚΫαΚœ…œ ω Β―ιΫαΙϊΥΒΟςΘΚΩΈΧβΉι―Γ‘ώœΓ ΆΚσc(Fe3+)ΈΣ 1.60mol/L Ήσ”“ΒΡάμ”… «______ΓΘ
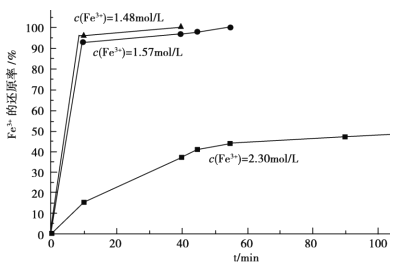
Θ®4Θ©‘ΎΙΐ≥ΧΔσ÷–Θ§ΩΈΧβΉι‘ΎœύΆ§ΧθΦΰœ¬Θ§œ»―Γ”ΟΝΥ≤ΜΆ§≥ΝΗΤΦΝΫχ–– Β―ιΘ§ Β―ι ΐΨίΦϊœ¬±μΘΚΘ®“―÷ΣΘΚ¬Υ“Κ B ÷–ΗΤΒΡΚ§ΝΩ“‘ CaO ΦΤΈΣ 290ΓΣ310mg/LΘ©
≥ΝΗΤΦΝ | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
”ΟΝΩ/g | 2 | 2 | 2 | 5 | 2 |
Θ”ύCaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
ΗυΨί Β―ιΫαΙϊΘ§ ―Γ‘ώ “ΥΒΡ≥ΝΗΤΦΝΘ§ΒΟΒΫ¬Υ‘ϋ C ΒΡ÷ς“Σ≥…Ζ÷”–__________ΓΘ
Θ®5Θ©‘ΎΙΐ≥ΧΔτ÷–Θ§Ζ¥”ΠΈ¬Ε»–η“ΣΩΊ÷Τ‘Ύ 35Γφ“‘œ¬Θ§≤Μ“ΥΙΐΗΏΘ§ΤδΩ…ΡήΒΡ‘≠“ρ «__________ΓΘ
Θ®6Θ©‘ΎΙΐ≥ΧΔθ÷–Θ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ «__________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ Β―ι “ΡΘΡβΙΛ“ΒΤ·ΑΉ“ΚΘ®”––ß≥…Ζ÷ΈΣNaClOΘ©Ά―≥ΐΖœΥ°÷–Α±ΒΣΘ®NH3Θ©ΒΡΝς≥Χ»γœ¬ΘΚ

œ¬Ν–Ζ÷Έω’ΐ»ΖΒΡ «
A. ΔΌ÷–≤…”Ο’τΝσΒΡΖΫΖ®ΨΪ÷Τ¥÷―ΈΥ°
B. ΔΎ÷–―τΦΪΒΡ÷ς“ΣΒγΦΪΖ¥”ΠΘΚ4OH- - 4e- = 2H2O + O2Γϋ
C. Δέ÷–÷Τ±ΗΤ·ΑΉ“ΚΒΡΖ¥”ΠΘΚCl2 + OH- = Cl- + HClO
D. ΔΎΓΔΔέΓΔΔή÷–ΨυΖΔ…ζΝΥ―θΜ·ΜΙ‘≠Ζ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœρΨχ»»Κψ»ίΟή±’»ίΤς÷–Ά®»κN2ΚΆH2Θ§‘Ύ“ΜΕ®ΧθΦΰœ¬ ΙΖ¥”ΠN2(g)+3H2(g)![]() 2NH3(g) ΓςHΘΦ0¥οΒΫΤΫΚβΘ§n(NH3)ΚΆn(H2)Υφ ±Φδ±δΜ·ΒΡΙΊœΒ»γΆΦΥυ ΨΓΘœ¬Ν–”–ΙΊ–π ω’ΐ»ΖΒΡ «( )
2NH3(g) ΓςHΘΦ0¥οΒΫΤΫΚβΘ§n(NH3)ΚΆn(H2)Υφ ±Φδ±δΜ·ΒΡΙΊœΒ»γΆΦΥυ ΨΓΘœ¬Ν–”–ΙΊ–π ω’ΐ»ΖΒΡ «( )
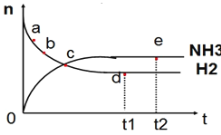
AΘ°cΒψ±μ ΨNH3…ζ≥…ΥΌ¬ ”κNH3Ζ÷ΫβΥΌ¬ œύΆ§
BΘ°cΒψΚΆeΒψ ±Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐœύΆ§
CΘ°N2ΒΡΉΣΜ·¬ ΘΚbΘΨa
DΘ°dΒψ ±Θ§n(N2):n(H2):n(NH3)=1:3:2
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩάϊ”Ο‘ΣΥΊΒΡΜ·ΚœΦέΆΤ≤βΈο÷ ΒΡ–‘÷ «Μ·―ß―–ΨΩΒΡ÷Ί“Σ ÷ΕΈΓΘ»γΆΦ «Νρ‘ΣΥΊΒΡ≥ΘΦϊΜ·ΚœΦέ”κ≤ΩΖ÷Έο÷ άύ±πΒΡΕ‘”ΠΙΊœΒΘΚ
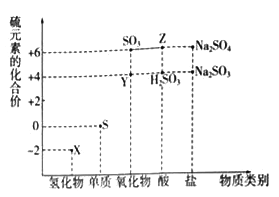
Θ®1Θ©¥”Νρ‘ΣΥΊΜ·ΚœΦέ±δΜ·ΒΡΫ«Ε»Ζ÷ΈωΘ§ΆΦ÷–Φ»”–―θΜ·–‘”÷”–ΜΙ‘≠–‘ΒΡΜ·ΚœΈο”–_______Θ®ΧνΜ·―ß ΫΘ©ΓΘ
Θ®2Θ©ΫΪX”κYΜλΚœΘ§Ω……ζ≥…Β≠ΜΤ…ΪΙΧΧεΘ§ΗΟΖ¥”Π÷–―θΜ·ΦΝ”κΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ_______ΓΘ
Θ®3Θ©ZΒΡ≈®»ή“Κ”κΆ≠ΒΞ÷ ‘Ύ“ΜΕ®ΧθΦΰœ¬Ω…“‘ΖΔ…ζΜ·―ßΖ¥”ΠΘ§ΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_______ΓΘ
Θ®4Θ©Na2S2O3 «÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΘ°¥”―θΜ·ΜΙ‘≠Ζ¥”ΠΒΡΫ«Ε»Ζ÷ΈωΘ§œ¬Ν–÷Τ±ΗNa2S2O3ΒΡΖΫΑΗάμ¬έ…œΩ…––ΒΡ «______Θ®Χν¥ζΚ≈Θ©ΓΘ
aΘ°Na2S+S bΘ°Na2SO3+S cΘ°SO2+Na2SO4 dΘ°Na2SO3+Na2SO4
Θ®5Θ©“―÷ΣNa2SO3Ρή±ΜK2Cr2O7―θΜ·ΈΣNa2SO4‘ρ24mL 0.05molL©¹1ΒΡNa2SO3»ή“Κ”κ 20mL 0.02molL©¹1ΒΡK2Cr2O7»ή“Κ«ΓΚΟΖ¥”Π ±Θ§Cr‘ΣΥΊ‘ΎΜΙ‘≠≤ζΈο÷–ΒΡΜ·ΚœΦέΈΣ________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ÷”–ΒΡΚΛΚœ≥…ΤχΘ§“Κ–ί»ΦΝœΚœ≥…Τχ÷ΤΗςΙΛ“’Η¥‘”«“ΡήΚΡΗΏΘ§÷–ΩΤ‘Κ¥σΝ§Μ·―ßΈοάμ―–ΨΩΥυΧα≥ω‘ΎΜλΚœΒΦΧεΆΗ―θΡΛΖ¥”ΠΤς÷–“Μ≤ΫΆ§ ±÷Τ±ΗΗ¥Κœ≥…ΤχΚΆ“ΚΧε»ΦΝœΚœ≥…ΤχΒΡΗ≈ΡνΘ§≤Δ»ΓΒΟ―–ΨΩΫχ’ΙΓΘΤδΙΛΉς‘≠άμ»γΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®¥μΈσΒΡ «

A. O2ΚΆH2OΨυΖΔ…ζΜΙ‘≠Ζ¥”Π
B. ΡΛΔώ≤ύœύΒ±”Ύ‘≠Βγ≥ΊΒΡ’ΐΦΪ
C. ΡΛΔρ≤ύΖΔ…ζΒΡΖ¥”ΠΈΣΘΚ CH4+O2--2e-=2H2+CO
D. ΡΛΔρ≤ύœϊΚΡCH4”κΡΛΔώ≤ύ…ζ≥…HΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ12
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Μ·―ß―ßœΑ–ΓΉι―ßœΑΒγΜ·―ßΚσΓΘ…ηΦΤΝΥœ¬ΟφΒΡ Β―ιΉΑ÷ΟΆΦ(Κœ…œΒγΦϋ):
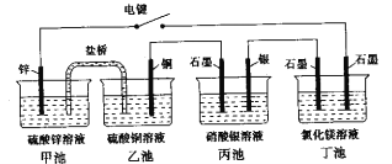
Θ®1Θ©ΒγΦΪΟϊ≥ΤΘ§Ά≠ΒγΦΪ___(Χν–¥ΓΑ’ΐΦΪΓ±ΓΔΓΑΗΚΦΪΓ±ΓΔΓΑ“θΦΪΓ±ΓΔΓΑ―τΦΪΓ±Θ§œ¬Ά§)Θ§“χΒγΦΪ_____ΓΘ
Θ®2Θ©±ϊ≥Ί ·ΡΪΒγΑε…œΖΔ…ζΒΡΒγΦΪΖ¥”Π ΫΈΣ_______Θ§ΕΓ≥Ί÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_______ΓΘ
Θ®3Θ©“ΜΕΈ ±ΦδΘ§Β±±ϊ≥Ί÷–…ζ≥…±ξΉΦΉ¥Ωωœ¬560mLΤχΧε ±Θ§ΕΓ≥Ί÷–άμ¬έ…œΉνΕύ≤ζ…ζ______gΙΧΧεΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗυΨίœ¬ΟφΒΡΖ¥”Π¬ΖœΏΦΑΥυΗχ–≈œΔΧνΩ’ΓΘ

Θ®1Θ©AΒΡΫαΙΙΦρ Ϋ « Θ§Οϊ≥Τ « ΓΘ
Θ®2Θ©ΔΌΒΡΖ¥”Πάύ–Ά « Θ§ΔέΒΡΖ¥”Πάύ–Ά « ΓΘ
Θ®3Θ©Ζ¥”ΠΔή ΒΡΜ·―ßΖΫ≥Χ Ϋ « ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΧλ»Μ ≥”ΟœψΝœX «ΖΦœψΉεΜ·ΚœΈοΘ§Ω…“‘¥”Ρ≥–©÷≤Έο÷–Χα»ΓΓΘ”…XΚœ≥…HΒΡ¬ΖœΏ»γœ¬ΘΚ

“―÷ΣΘΚΔΌAΒΡΚΥ¥≈Ι≤’ώ«βΤΉ”–6ΗωΖεΘΜΔΎHΈΣθΞάύΈο÷ Θ§ΫαΙΙ÷–≥ΐ±ΫΜΖΆβΜΙΚ§”–“ΜΗωΝυ‘ΣΜΖΘΜΔέGΒΡ≤ζΝΩ «ΚβΝΩ“ΜΗωΙζΦ“ ·”ΆΜ·ΙΛΖΔ’ΙΥ°ΤΫΒΡ±ξ÷ΨΓΘ
«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©AΒΡΫαΙΙΦρ ΫΈΣ______Θ§Φλ―ιA÷–Ζ«Κ§―θΙΌΡήΆ≈Υυ”ΟΒΡ ‘ΦΝΈΣ_______ΓΘ
Θ®2Θ©ΔΎΒΡΖ¥”Πάύ–ΆΈΣ____________ΓΘΖ¥”ΠΔέΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_____________ΓΘ
Θ®3Θ©F÷–ΥυΚ§ΙΌΡήΆ≈ΒΡΟϊ≥ΤΈΣ____________Θ§ΤδΆ§Ζ÷“λΙΙΧε÷–Θ§”ωFeCl3»ή“ΚΖΔ…ζœ‘…ΪΖ¥”ΠΘ§«“Ρή”κΧΦΥα«βΡΤ»ή“ΚΖ¥”ΠΘ§Τδ±ΫΜΖ…œ“Μ¬»¥ζΈο÷Μ”–“Μ÷÷Θ§ΖϊΚœΧθΦΰΒΡΆ§Ζ÷“λΙΙΧε ΐΡΩΈΣ________÷÷Θ§–¥≥ωΤδ÷–“Μ÷÷ΫαΙΙΦρ ΫΘΚ____________ΓΘ
Θ®4Θ©…ηΦΤ“ΜΧθ“‘GΈΣΤπ Φ‘≠ΝœΚœ≥…““ΕΰΥαΒΡ¬ΖœΏ______________Θ§ΈόΜζΈο»Έ―ΓΘ§ΉΔΟςΖ¥”ΠΧθΦΰΓΘ Ψάΐ»γœ¬ΘΚ ![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com