

| ||
| ||
| ||
| 240×0.8g |
| 160 |
| 1.2g |
| 1.5g |
| ||
| ||
| ||
| ||
| ||
| 240×0.8g |
| 160 |
| 1.2g |
| 1.5g |
| ||


科目:高中化学 来源: 题型:
| A、手机上用的锂离子电池属于二次电池 |
| B、铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C、铜锌原电池工作时,锌电极发生氧化反应 |
| D、锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物:石炭酸、水玻璃、水银 |
| B、化合物:乙醇、漂白粉、HD |
| C、电解质:明矾、冰醋酸、硫酸钡 |
| D、同系物:CH2O2、C2H4O2、C3H6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
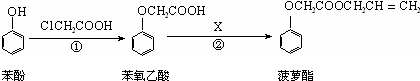
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用BaCl2溶液鉴别SO3(g)和SO2 |
| B、用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
| C、用CO2鉴别NaAlO2溶液和Na2SiO3溶液 |
| D、用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com