
【题目】在容积为2L的容器内,发生反应2A(s)+3B(g) ![]() 2C(g)+D(g),起始时充入3molA和2.5molB混合气体;经过5min生成0.5molD,下列说法正确的是
2C(g)+D(g),起始时充入3molA和2.5molB混合气体;经过5min生成0.5molD,下列说法正确的是
A.若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态
B.C的平衡浓度为2mol/L
C.5min内B的平均消耗速率为0.3mol/(L·min)
D.平衡后,增大压强,平衡向正反应方向移动
【答案】A
【解析】
试题分析:A、生成B为逆反应速率,生成D为正反应速率,当二者的比值等于计量数之比即是平衡状态,故A正确;B、起始时充入3molA和2.5molB混合气体;经过5min生成0.5molD,
2A(s)+3B(g)![]() 2C(g)+D(g),
2C(g)+D(g),
起始量(mol) 3 2.5 0 0
变化量(mol) 1 1.5 1 0.5
5min时(mol) 2 1 1 0.5
5min时 c(C)=0.5mol/L,平衡时浓度无法确定,故B错误;C、参加反应的B为1.5mol,所以v(B)=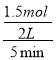 =0.15mol/(Lmin),故C错误;D、反应前后气体的体积不变,增大压强平衡不移动,故D错误;故选A。
=0.15mol/(Lmin),故C错误;D、反应前后气体的体积不变,增大压强平衡不移动,故D错误;故选A。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H20(g) ΔH=-1025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H20(g) ΔH=-1025 kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期的主族元素,在周期表中的相对位置如图所示,下列说法正确的是

A. 若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B. 若四种元素均为非金属,则W的最高价氧化物对应水化物一定为强酸
C. 若四种元素中只有一种为金属,则Y的最高价氧化物对应水化物一定为强酸
D. 若四种元素均为金属,则Z的最高价氧化物对应水化物一定为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】构成DNA、唾液淀粉酶、固醇、纤维素的化学成分中,共有的化学元素是
A. C、H、0、N、P B. C、H、0、N、S
C. C、H、0 D. C、H、0、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年9月3日,二十国集团领导人杭州峰会之前,中国政府率先签署了《巴黎协定》并向联合国交存批准文书,体现中国为应对全球气候变化做出了重要贡献。为减少CO2对环境造成影响,有科学家提出设想,先把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇,流程如下:
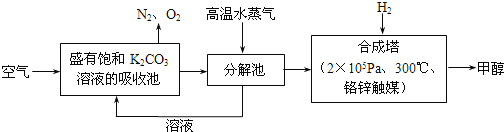
(1)写出分解池中反应的化学方程式___________________。
(2)在合成塔中,当有8.8gCO2与足量H2完全反应,可放出9.84×l03kJ的能量,写出合成塔中反应的热化学方程式______________________。
(3)在体积为l L的密闭容器中,充入1molCO2和3molH2在300℃下发生反应,有关物质的浓度随时间变化如下图所示。
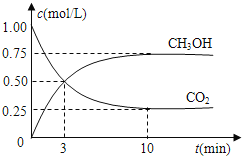
①从反应开始到平衡,H2的平均反应速率v(H2)=_______ _____。
②其他条件不变,只将温度提高到500℃,再次平衡时n(CH3OH)/n(CO2)比值___________(填“增大”、“减小”或“不变”)。
③从平衡移动原理分析,低温有利于提高原料气的转化率,而实际生产中采用300℃的温度,原因是_______________。
(4)目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H>0。
CH3OCH3(g)+3H2O(g) △H>0。
判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是_________。
a.容器中密度不变
b.单位时间内消耗2molCO2,同时消耗1mol二甲醚
c.v(CO2):v(H2)=1:3
d.容器内压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】〔化学-化学与技术〕
工业中以铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2)为原料冶炼铝过程如图所示:

(1) 实验室进行过滤用到的玻璃仪器有烧杯、_____________、_____________。
(2) 操作II中生成不溶物C的离子方程式是 。
(3) 氧化铝的熔点高达2050℃,工业上为降低能耗,在铝的电解冶炼时,采取的措施是 。
(4) 电解冶炼铝时,阳极和阴极以碳素材料制成,电解过程中,阳极材料需定期进行更换,原因是 。
(5) 为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用。其部分转化关系如下图所示:
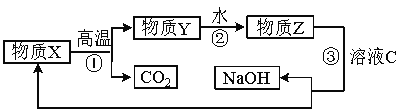
① 上述转化中未涉及四种基本反应类型中的 反应;
② 写出过程③的化学方程式: 。
(6) 研究表明,人体过量吸入铝元素会严重危害身体健康。请你结合实际提出两条杜绝铝元素过量吸入的措施:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配平下列化学方程式或离子方程式。
(1)![]() KI+
KI+![]() KIO3+
KIO3+![]() H2SO4=
H2SO4=![]() I2+
I2+![]() K2SO4+
K2SO4+![]() H2O
H2O
(2)![]() MnO+
MnO+![]() H++
H++![]() Cl-=
Cl-=![]() Mn2++
Mn2++![]() Cl2↑+
Cl2↑+![]() H2O
H2O
(3)![]() P4+
P4+![]() KOH+
KOH+![]() H2O=
H2O=![]() K3PO4+
K3PO4+![]() PH3
PH3
(4)![]() ClO-+
ClO-+![]() Fe(OH)3+
Fe(OH)3+![]() ________=
________=![]() Cl-+
Cl-+![]() FeO+
FeO+![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(?)+a B(g)![]() C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
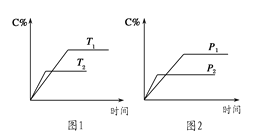
A.当压强由p1变为 p2时,逆反应速率将变大
B.该反应的正反应为放热反应
C.若a=2,则A为液态或固体
D.恒温恒容条件下,增加B的物质的量,B的转化率和该反应的化学平衡常数都将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com