
����Ŀ������ѧ-��ѧ�뼼����
��ҵ����������(��Ҫ�ɷ�ΪAl2O3��������Fe2O3��SiO2)Ϊԭ��ұ����������ͼ��ʾ��

��1�� ʵ���ҽ��й����õ��IJ����������ձ���_____________��_____________��
��2�� ����II�����ɲ�����C�����ӷ���ʽ�� ��
��3�� ���������۵�ߴ�2050������ҵ��Ϊ�����ܺģ������ĵ��ұ��ʱ����ȡ�Ĵ�ʩ�� ��
��4�� ���ұ����ʱ��������������̼�ز����Ƴɣ��������У����������趨�ڽ��и�����ԭ���� ��
��5�� Ϊ������ۺϾ���Ч�棬ʵ�ʹ�ҵ�����г���������Ӧ�е��������ѭ�����á��䲿��ת����ϵ����ͼ��ʾ��
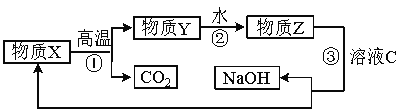
�� ����ת����δ�漰���ֻ�����Ӧ�����е� ��Ӧ��
�� д�����̢۵Ļ�ѧ����ʽ�� ��
��6�� �о��������������������Ԫ�ػ�����Σ�����彡����������ʵ����������ž���Ԫ�ع�������Ĵ�ʩ��____________��
���𰸡���1��©����������(2��)
��2��CO2��2H2O��AlO2����Al(OH)3����HCO3��(��CO2��[Al(OH)4]����Al(OH)3����HCO3��)
��3���������ʯ��Na3AlF6�����������������۵�(2��)
��4������������������̼������Ӧ���ɶ�����̼(2��)��5�����û�(1��)
��NaHCO3��Ca(OH)2===CaCO3����NaOH��H2O(3��)
��6����������Ʒ��������������װʳƷ�������������𰸣�(2��)
��������
�����������1������ʵ���õ��IJ����������ձ�����������©����
��2���������з����ķ�Ӧ�ǣ�ͨ��Ķ�����̼�����к���Һ�е��������ƣ�Ȼ��ƫ�����ƺͶ�����̼��Ӧ��������������̼���ƣ����ɲ�����BΪ�������������ӷ���ʽ�ǣ�OH����CO2��HCO3�D��CO2��2H2O��AlO2 ����Al(OH)3����HCO3����
��3�������۵�ߣ�Ҫ�ۻ����ü������ۼ�����ʯ��
��4���������У������ϲ����������ܺ�̼��Ӧ���ɶ�����̼�������ĵ�̼����������ϵ�̼Ҫ���ڲ��䣻
��5������ҺB��̼���ƣ����Ժ��������Ʒ������ֽⷴӦ����̼��ƺ��������ƣ�����X��̼��ƣ�Y�������ƣ�Z���������ƣ��漰���˷ֽⷴӦ�����Ϸ�Ӧ�Լ����ֽⷴӦ�����漰�û���Ӧ��
�������Т۵Ļ�ѧ����ʽΪ��NaHCO3��Ca(OH)2==CaCO3����NaOH��H2O�����ڸ��ֽⷴӦ��
��6�����漰��ʳ���װ���京����Ԫ�ص�ҩƷʱҪע�⾡���ܵı��⣬�磺�����ٺ����ư�װ�����ϡ�ʳƷ���ٳ���������������θҩ�ȡ�


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCO3��ɰ�ǻ��ÿ�������Ѫ����ʵ�������Ʊ�FeCO3��������ͼ��ʾ������˵��������ǣ� ��

A����ƷFeCO3�ڿ����и��·ֽ�ɵõ�������FeO
B��������KSCN��Һ����FeSO4��Һ�Ƿ����
C��������������CO2����ų�
D����������Ƿ�ϴ�Ӹɾ����������ữ��BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ھ�������β���ķ�Ӧ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)����֪�÷�Ӧ���ʼ�����570Kʱƽ�ⳣ��Ϊ1��1059������˵����ȷ����
2CO2(g)+N2(g)����֪�÷�Ӧ���ʼ�����570Kʱƽ�ⳣ��Ϊ1��1059������˵����ȷ����
A��װ��β������װ�õ������ų���������һ�����ٺ���NO��CO
B�����β������Ч�ʵij��÷����������¶�
C�����β������Ч�ʵ����;�������Ƹ�Ч����
D��570Kʱ�÷�Ӧ������еij̶Ⱥܴ�ʹ�ô�������ʵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2L�������ڣ�������Ӧ2A(s)+3B(g) ![]() 2C(g)+D(g)����ʼʱ����3molA��2.5molB������壻����5min����0.5molD������˵����ȷ����
2C(g)+D(g)����ʼʱ����3molA��2.5molB������壻����5min����0.5molD������˵����ȷ����
A������λʱ�������ɵ�B��D�����ʵ���֮��Ϊ3��1������ϵ����ƽ��״̬
B��C��ƽ��Ũ��Ϊ2mol/L
C��5min��B��ƽ����������Ϊ0.3mol/(L��min)
D��ƽ�������ѹǿ��ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й������֬�ʵ�����������ȷ���ǣ� ��
A. ֬���е���֬�ǹ���ϸ��Ĥ����Ҫ���ʣ�����ϸ����������֬
B. ֲ��ϸ���еĶ�����Ҫ�ǵ��ۺ���ά�أ�����ϸ���еĶ�����Ҫ�����Ǻ���ԭ
C. �̴���������ϸ���ĵ��ںʹ�л�о�����Ҫ����
D. �����ǡ����ǡ����������Ƕ�ֲ��ϸ�����еĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���������������ʵ���( )
A��HCl B��Ba(OH)2 C��CO2 D��NH3��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����ʽṹ�����������Ļ�����������������������Ҫ�ĵ�λ����ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ͼΪ ��
��2���������������Ϊ��ɫ���壬�����������ӹ��ɣ���֪�������ӹ���Ϊƽ���������Σ����������ӵĹ���Ϊ �Σ��������е����ӻ���ʽΪ ��
��3��ij����������X�������¡�������������Ժõ��������ʣ��㷺�����մɹ�ҵ������ҵ���õ�������������̼��һ�������·�Ӧ����CO��X (X�ľ���ṹ��ͼ��ʾ������ҵ�Ʊ� X �Ļ�ѧ����ʽΪ ��

��4��X�����а����Ļ�ѧ������Ϊ ������ĸ��ţ���
A �����Ӽ� B �����ۼ� C ����λ�� D ��������
��5����֪��������X����������ͬ���ҵ�������۵��X�ߣ���ԭ���� ��
��6����X���ܶ�Ϊ��g/cm3�����������������Al ԭ�ӵľ���Ϊ cm �������ӵ������� NA��ʾ�����ػ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�㶨�¶��£���һ��2 L���ܱ������г���A���塢B���壬�����Ũ��2 mol/L��1 mol/L���ҷ������·�Ӧ��3A(g)+2B(g)![]() 2C(��)+3D(��)��H =+a kJ��mol-1����֪����������C��D״̬δȷ������Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C���ҷ�Ӧǰ��ѹǿ��Ϊ5��3��������˵������ȷ����
2C(��)+3D(��)��H =+a kJ��mol-1����֪����������C��D״̬δȷ������Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C���ҷ�Ӧǰ��ѹǿ��Ϊ5��3��������˵������ȷ����
A������������������£������ϵ�г���He������Ӧ���ʼӿ죬ƽ������
B����ʱB��ת����Ϊ20%
C���������ϵѹǿ��ƽ�������ƶ�������ѧƽ�ⳣ������
D������C������A��Bת���ʼ�С����H��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol��L��1 CH3COOH��Һ�д������µ���ƽ�⣺CH3COOH![]() CH3COO����H�������ڸ�ƽ�⣬����������ȷ���� ( )
CH3COO����H�������ڸ�ƽ�⣬����������ȷ���� ( )
A������ˮʱ��ƽ�����淴Ӧ�����ƶ�
B���������������ᣬƽ��������Ӧ�����ƶ�������̶ȼ�С
C����������0.1 mol��L��1 HCl��Һ����Һ��c(H��)��С
D����������CH3COONa���壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com