
下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是


 每课必练系列答案
每课必练系列答案科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列变化过程中,?S<0的是
A.蔗糖溶于水 B.氢气与氯气合成氯化氢
C.氨气与氯化氢合成氯化铵 D.加热KMnO4制O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 mol·L-1 氨水中加入少量水,pH减小, 减小
减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第二次月考化学试卷(解析版) 题型:推断题
(8分)现有A-G七种物质,已知A是赤铁矿的主要成分,E是浓溶液稀释时会放出大量的热,G溶液为蓝色,它们之间存在如图所示的转化关系。

(1)写出下列物质的化学式;E: ,D: .
(2)在反应①②③中,属于置换反应的是 (填序号)。
(3)工业上常利用反应①的原理练铁,写出反应①的化学方程式 。
(4)写出物质C与E的稀溶液发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列叙述错误的是
①热稳定性:H2O>HF>H2S ②Fe是副族元素 ③IIA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布 ④元素周期表中从IIIB到IIB族10个纵行的元素都是金属元素 ⑤多电子原子中,在离核较近的区域内运动的电子能量较高 ⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq)△H=—114.6kJ/mol,则中和热为-57.3kJ·mol-1 ⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含金属键
A、②④⑥ B、①⑤⑥ C、②③④ D、①②⑤⑦
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是

A、A B、B C、C D、D
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三上学期期末考试化学试卷(解析版) 题型:填空题
(9分)盐酸常用于清除金属表面的铜锈铁锈。某同学欲将除锈后的盐酸中的金属元素分步沉淀,查资料获知常温下水溶液中各离子沉淀的pH范围:
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 0 | 3. 0 |
Fe2+ | 5. 8 | 8. 8 |
Cu2+ | 4.2 | 6.7 |
(1)若以离子浓度降至1×10-5 mol·L-1为沉淀完全,根据上表数据推算出ksp[Fe(OH)3]=
(2)根据上述数据该同学设计了以下实验流程:
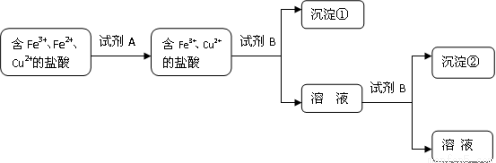
A可能是 ;试剂B的化学式是 ;沉淀②化学式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三上学期期末考试化学试卷(解析版) 题型:选择题
常温时能与水反应产生H2的是
A.Na B.NH4Cl C.Na2O2 D.NO2
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:实验题
(8分)阅读下列实验内容,根据题目要求回答问题。
实验室中有一未知浓度的稀盐酸,某学生用0.100mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
(1)滴定达到终点的标志是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后叁位)。
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为 mL。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com