
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是

A、A B、B C、C D、D
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列关于铜电极的叙述正确的是
A.铜锌原电池中铜是负极 B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用铜作阳极 D.电解食盐水时铜作阳极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省七校联盟高三第一次联考理综化学试卷(解析版) 题型:填空题
【化学-选修2:化学与技术】(15分)
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:
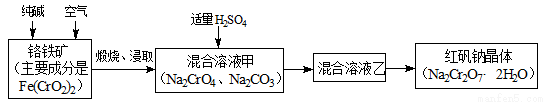
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成__________。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+ 8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 。为了加快该反应的反应速率,可采取的措施是___。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的是__________________________________________。
②混合溶液乙中溶质的化学式是_________________________________________________。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K=________,若继续加水稀释,平衡将_________移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K=________,若继续加水稀释,平衡将_________移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
有XYZ三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16,X,Y,Z三种元素的常见单质在适当条件下可发生如下变化,其中B和C均为10电子分子。下列说法不正确的是

A、X元素位于VIA B、A不能溶解于B中
C、B的沸点大于C的沸点 D、A和C不可能发生氧化还原反应。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三上学期期末考试化学试卷(解析版) 题型:实验题
(8分)为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:

(1)实验仪器A的名称为 。
(2)装置C中浓硫酸的作用是 。
(3)若测得装置D中干燥管实验前后增重了4.8g,由此可计算出该样品中亚硫酸钠的纯度为 。
(4)该实验方案存在明显缺陷,会使测定结果 (填“偏高”或“偏低”)。为使结果准确,你的建议是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关电化学的叙述正确的是

A.为实现铁上镀铜,可把铁作为阳极
B.氯碱工业通过电解熔融的NaCl生产Cl2
C.如上图所示,盐桥中的K+ 移向ZnSO4溶液
D.氢氧燃料电池(碱性电解质溶液)中O2通入正极,电极反应为O2+2H2O+4e-===4OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列关于金属腐蚀的叙述不正确的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.与生铁相比纯铁更容易被腐蚀
C.金属的吸氧腐蚀和析氢腐蚀都属于电化学腐蚀
D.金属腐蚀的本质是M - ne‑ = Mn+
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
有如下实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是:
A.滤液b中不含有Ag+
B.浊液a中存在沉淀溶解平衡:AgCl(g)  Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com