
����Ŀ��Mg��ClO3��2��ũҵ�Ͽ�������Ҷ������������ɲ��ø��ֽⷴӦ�Ʊ���MgCl2+2NaClO3�TMg��ClO3��2+2NaCl����֪Mg��ClO3��2���ܽ�ȣ�S�����¶ȣ�T���ı仯������ͼ��ʾ�������й������в���ȷ���ǣ� �� 
A.�¶�Խ�ߣ�Mg��ClO3��2������Һ�����ʵ���Ũ��Խ��
B.�¶�Խ�ߣ�Mg��ClO3��2������Һ����������Խ��
C.350Kʱ��Mg��ClO3��2������Һ�����ʵ���Ũ��Ϊ ![]()
D.350 Kʱ��Mg��ClO3��2������Һ����������Ϊ ![]() ��100%
��100%
���𰸡�C
���������⣺A����ͼ���֪�������¶ȵ����ߣ�Mg��ClO3��2���ܽ���������¶�Խ�ߣ�Mg��ClO3��2������Һ�����ʵ���Ũ��Խ��A��ȷ��B����ͼ���֪�������¶ȵ����ߣ�Mg��ClO3��2���ܽ���������¶�Խ�ߣ�Mg��ClO3��������Һ����������Խ��B��ȷ��
C��350Kʱ��Mg��ClO3��2������Һ���ܽ��Ϊ250g��������Һ�������֪�����������ʵ���Ũ�ȣ���C����
D��350Kʱ��Mg��ClO3��2������Һ���ܽ��Ϊ250g����100gˮ�����ʵ�����Ϊ250g������Һ����������Ϊ ![]() ��100%=
��100%= ![]() ��100%����D��ȷ��
��100%����D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ� ��CH3OH��g��+H2O��g��=CO2��g��+3H2��g������H=+49.0 kJmol��1
��CH3OH��g��+1/2O2��g��=CO2��g��+2H2��g������H=��192.9 kJmol��1
����˵����ȷ���ǣ� ��
A.��Ӧ���е������仯��ͼ��ʾ
B.![]()
C.CH3OHת���H2�Ĺ���һ��Ҫ��������
D.���ݢ���֪��Ӧ�� ![]() ?�ġ�H����192.9kJ?mol��1
?�ġ�H����192.9kJ?mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������A��B��C��D������ͼת����ϵ�� 
��1����D���ȼҵ����Ҫ��Ʒ��B���������������Ӧ�ڵ����ӷ���ʽ�ǣ�
��2����A��һ�ּ������壬�������������B������β��֮һ�����������ɫ����Ӧ�ٵĻ�ѧ����ʽΪ
��3����AΪ�����ӷ���ǿ�ᣬD���������������������;���Ľ������ʣ���B�Ļ�ѧʽ������ �� д����Ӧ�ڵ����ӷ���ʽΪ ��
��4����A��C��D���dz������壬C���γ��������Ҫ���壬��Ӧ�۵Ļ�ѧ����ʽ ��
��5����A��B��C��ˮ��Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��DΪCO2 �� �����ӷ���ʽ����B��Һ
�Լ��Ե�ԭ�������ӷ���ʽ��ʾ�� �� �ٳ�C��һ����; ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�������Ŀ��
��1������֮��Ϊ7��6����������CO��NO��������֮��Ϊ����ԭ����֮��Ϊ����ͬ�����µ����֮��Ϊ ��
��2������mgij���壬����˫ԭ�ӷ��ӹ��ɣ�����Ħ������ΪMgmol��1 �� �������ӵ�������NA��ʾ���ٸ���������ʵ���Ϊmol��
�ڸ���������ԭ������Ϊ����
�۸������ڱ�״���µ����ΪL��
�ܸ���������1Lˮ�У������Ƿ�Ӧ��������Һ�����ʵ���������Ϊ ��
�ݸ���������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��ΪmolL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ɫ����MxFey��CN��6�������ӵ���С�ṹ��Ԫ��ͼ���Ǹþ��徧���İ˷�֮һ������˵����ȷ���ǣ� �� 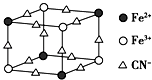
A.�þ����������Ӿ��壬M��+2��
B.�þ������ڷ��Ӿ��壬��ѧʽΪMFe2��CN��6
C.�þ�������ÿ��Fe3+��������������CN��Ϊ12��
D.�þ����һ�������к��е�M+�ĸ���Ϊ4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ΪԪ�����ڱ���һ���֣����еı�Ŵ�������Ӧ��Ԫ�أ���ش��������⣺ 
��1�����Ԫ�صĻ�̬ԭ�ӵļ۵����Ų�ʽ�� �� ����ͬ���ڣ��һ�̬ԭ�ӵĺ���δ�ɶԵ���������Ԫ������д��Ԫ�ط��ţ���
��2���ܺ���ߺ�Ԫ���γɵ���������۵��ɸߵ��͵��� ��
��3���ٺ���ۺ�Ԫ���γɵĺ���18���ӵķ���Ϊ��д�����ƣ����÷����Тۺ�Ԫ�ص�ԭ�ӵ��ӻ���ʽΪ �� �ڡ��ܡ�������Ԫ�ص�ԭ���γɵľ��壬�侧���Ľṹ�ص���ͼ��ʾ����û�����Ļ�ѧʽΪ���ö�Ӧ��Ԫ�ط��ű�ʾ���� 
��4���±���ijЩ������Ԫ�صĵ縺��ֵ��
Ԫ�ط��� | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
�縺�� | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
��ͨ�������縺��ֵ�仯���ɣ�ȷ��N��ӽ��ĵ縺��ֵ��Χ����N�� ��
���Ʋ�縺��ֵ��ԭ�Ӱ뾶��ϵ�� ��
�����ƶϣ�AlBr3�л�ѧ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100molL��1 NaOH��Һ�ֱ�ζ�20.00mL 0.100molL��1������ʹ��ᣬ�ζ�������ͼ��ʾ������˵����ȷ���ǣ� �� 
A.���ʾ���ǵζ����������
B.pH=7ʱ���ζ��������ĵ�V��NaOH��С��20mL
C.V��NaOH��=20.00mLʱ��������Һ��c��Cl����=c��CH3COO����
D.V��NaOH��=10.00mLʱ��������Һ��c��Na+����c��CH3COO������c��H+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������OH�������·���ˮ�ⷴӦ�� O2NC6H4COOC2H5+OH��O2NC6H4COO��+C2H5OH
���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050molL��1 �� 15��ʱ���O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
��/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
��1����ʾ����÷�Ӧ��120��180s��180��240s�����ƽ����Ӧ���������Ƚ����ߴ�С�ɵó��Ľ����� ��
��2����ʽ����15��ʱ�÷�Ӧ��ƽ�ⳣ�� ��
��3��Ϊ���O2NC6H4COOC2H5��ƽ��ת���ʣ������ʵ����Ʒ�Ӧ�¶��⣬���ɲ�ȡ�Ĵ�ʩ����Ҫ��д����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.�ö��Ե缫���Na2SO4��Һ������������������ʵ���֮��Ϊ1��2
B.��ԭ��صĸ����͵��ص������϶��Ƿ���ʧ���ӵ�������Ӧ
C.�ö��Ե缫��ⱥ��NaCl��Һ������1 mol����ת�ƣ�������1 molNaOH
D.�Ʋ������������ȶ�п�������ʴ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com