
【题目】一定条件下,向体积为1L的密闭容器中充入1molCO2和4molH2,测得CO2和CH3OH(g)的浓度随时间的变化如图所示。下列叙述中正确的是
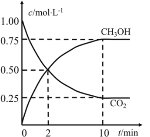
A.该反应的化学方程式为:CO2(g)+4H2(g)2CH3OH(g)
B.10min时,反应停止
C.2min时,CO2的消耗速率等于CH3OH的消耗速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L·min)
【答案】D
【解析】
A.根据图像可知,CO2的浓度减小,CH3OH(g)的浓度增加,故CO2和氢气是反应物,CH3OH是生成物,反应的化学方程式为:CO2(g)+3H2(g)CH3OH(g)+H2O,故A错误;
B.10min时,各物质的浓度保持不变,说明反应达到平衡状态,并不是停止了,故B错误;
C.从图像可以看出,2min时,CO2的浓度变化量等于CH3OH的浓度变化量,CO2的消耗速率等于CH3OH的生成速率,并没有达到平衡状态,故C错误;
D.根据图像可知,从反应开始到平衡,CO2的平均反应速率v(CO2)=![]() ,根据化学反应,CO2(g)+3H2(g) CH3OH(g) H2O,v(H2)=3v(CO2) =0.225mol/(L·min),故D正确;
,根据化学反应,CO2(g)+3H2(g) CH3OH(g) H2O,v(H2)=3v(CO2) =0.225mol/(L·min),故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如图所示(夹持仪器已略去)。请回答下列问题:
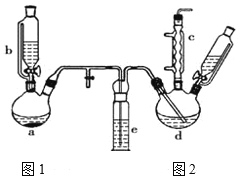
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。打开仪器a中的活塞,使浓盐酸缓缓滴下,仪器中产生黄绿色气体,用离子方程式表示产生该现象的原因:____。
(2)仪器b中细玻璃导管的作用是_____。
(3)仪器d内盛有苯、FeCl3粉末,仪器a中生成的气体经过仪器e进入到仪器d中。
①仪器e的名称是洗气瓶,内盛装的试剂是____;
②仪器d中的反应进行过程中,保持温度在40-60℃,以减少副反应发生。仪器d的加热方式最好采用___加热。
(4)仪器c的作用是___;d中发生的化学反应方程式是____。
(5)该方法制备的氯苯中含有很多杂质,工业生产中通过水洗,然后通过碱洗,再水洗,最后通过分液得到含氯苯的有机物的混合物,混合物成分及沸点如图2表格所示:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
①碱洗前先进行水洗的目的是____;
②取该有机物的混合物中的氯苯时,采用蒸馏的方法,收集___℃左右的馏分。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是( )
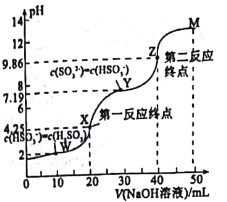
A.Ka2(H2SO3)的数量级为10-8
B.向X点加入少量澄清石灰水溶液,![]() 的值增大
的值增大
C.若将n(NaHSO3)与n(Na2SO3)=1:1混合,对应的点应在Y、Z之间
D.图中溶液中水的电离程度:W<X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2—苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A.不能使稀酸性高锰酸钾溶液褪色B.与甲苯互为同系物
C.最多能与4molBr2发生加成反应D.与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,能量转化如图,下列说法正确的是
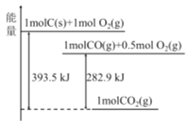
A.热化学方程式2CO(g)+O2(g)=2CO2(g)+282.9kJ
B.CO2是由极性键构成的极性分子
C.1molC(s)与1molCO2(g)生成2molCO(g)反应为放热反应
D.相同条件下,1molC(s)和0.5molO2(g)总能量高于1molCO(g)的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学与生产.生活相关的说法正确的是
A.生铁、青铜等合金比纯金属耐腐性强
B.石油主要由各种烃组成的混合物,可以通过分馏的方法分离出C8H18
C.分离工业合成氨产品的方法是将氨气液化
D.氨的催化氧化的适宜条件为高温、高压、催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物与人类生产、生活密切相关。
(1)已知:S(s)+O2(g)= SO2(g) ΔH1=-a kJ·mol-1
S(g)+O2(g)= SO2(g) ΔH2=- b kJ·mol-1
则a___(填“>”或“<”)b。
(2)在一定温度和压强下,将2molSO2和1molO2置于密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),并达到平衡。
2SO3(g),并达到平衡。
①若再加入1 molO2,该平衡向___(填“正”或“逆”)反应方向移动;
②若降低温度,达到平衡时测得SO2的含量减少,则正反应是___(填“吸热”或“放热”)反应;
③该反应的化学平衡常数表达式K=___。若只增大压强,则K__(填“增大”“减小”或“不变”)。
(3)常温下,现有0.5mol·L-1Na2SO3溶液,请判断:(Na2SO3第一步水解的离子方程式是SO32-+H2O![]() HSO3-+OH-)
HSO3-+OH-)
①该溶液的pH___(填“>”或“<”)7;
②该溶液中c(Na+)___(填“>”或“<”)2c(SO32-);
③盐类水解反应是吸热反应。加热该溶液,SO32-的浓度将__(填“增大”或“减小”)。
(4)如图是电解硫酸铜溶液的装置。
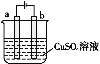
①若a、b为石墨电极,b电极的质量增加,写出该极的电极反应式:___;
②电镀是电解原理的一种重要应用。若利用该装置在铁件上镀铜,则铁件应与电源的__ (填“正极”或“负极”)连接。
(5)已知硫酸钡的沉淀溶解平衡为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸钡的饱和溶液中Ba2+的浓度为____mol·L-1。
Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸钡的饱和溶液中Ba2+的浓度为____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的密闭容器中发生反应:C(s)+H2O(g) ![]() CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
A. 容器内CO的物质的量分数保持不变B. 容器内体系的压强保持不变
C. 容器内气体的密度保持不变D. 单位时间内消耗1molH2O(g),同时生成1molCO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是( )

① | ② | ③ | ④ | |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | Na2SO4 | K2SO4 | KCl | NH4Cl |
C | NaCl | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com