
【题目】一定温度下,在容积固定的密闭容器中发生反应:C(s)+H2O(g) ![]() CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
A. 容器内CO的物质的量分数保持不变B. 容器内体系的压强保持不变
C. 容器内气体的密度保持不变D. 单位时间内消耗1molH2O(g),同时生成1molCO(g)
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下,则下列判断正确的是( )
![]()
A.MFe2Ox是氧化剂
B.SO2是该反应的催化剂
C.x<y
D.MFe2Oy是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向体积为1L的密闭容器中充入1molCO2和4molH2,测得CO2和CH3OH(g)的浓度随时间的变化如图所示。下列叙述中正确的是
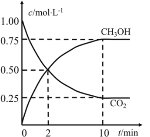
A.该反应的化学方程式为:CO2(g)+4H2(g)2CH3OH(g)
B.10min时,反应停止
C.2min时,CO2的消耗速率等于CH3OH的消耗速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。LiCoO2是锂离子电池最早使用的电极材料,利用原钴矿(主要成分为Co2O3)制备LiCoO2的工艺流程如图:
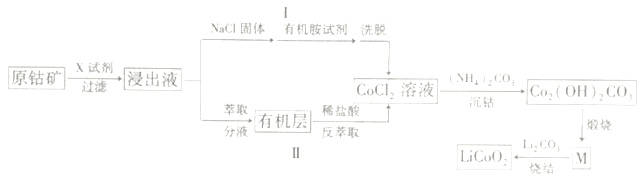
资料:在含一定量Cl-的溶液中,Co2+以CoCl42-形式存在:Co2++4C1-![]() CoCl42-
CoCl42-
(1)若“X试剂”是稀H2SO4和H2O2,则H2O2的作用是___。
(2)若“X试剂”是盐酸,写出离子反应方程式___。
(3)途径I中加入NaCl固体的目的___(用平衡移动原理解释)。
(4)“沉钴”过程中,为了提高Co2(OH)2CO3的产量,温度不宜过高的原因是___。
(5)已知M是钴的某种氧化物,63.6gCo2(OH)2CO3,煅烧成物质M时转移电子0.4mol,则M的化学式为___;写出“烧结”的化学方程式___。
(6)取mg样品溶于稀硫酸,加入过量KI溶液,再用cmol·L-1Na2S2O3标准液滴定(淀粉溶液做指示剂),达到滴定终点时,消耗Na2S2O3溶液VmL,则产品中钻元素的百分含量为___。
(有关反应:LiCoO2+4H+=Li++Co3++2H2O,2Co3++2I-=2Co2++I2,I2+2S2O32-=S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季节是流感发作的高峰期,“84消毒液”能有效杀灭流感病毒。三台中学某同学购买的“84消毒液”瓶体部分标签如图所示,通常稀释100倍(体积比)后使用。请回答下列问题:
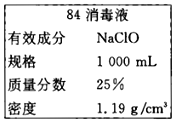
(1)该“84消毒液”的物质的量浓度约为______mol/L。
(2)该同学参阅“84消毒液”的配方,欲用NaClO固体配制240 mL浓度为0.4mol/L的消毒液:
①需要用托盘天平称量NaClO固体的质量为____________g。
②实验中所用的玻璃仪器除烧杯、玻璃棒、量筒外,还有_____________________。
(3)实验过程中下列操作或说法不正确的是_______________。
A、容量瓶用蒸馏水洗净之后,应烘干后才能用于溶液的配制
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致所得溶液浓度偏低
C、定容时,俯视刻度线会导致所得溶液浓度偏低
D、摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用铂丝按如图进行氨的催化氧化实验,下列说法正确的是( )
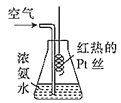
A.通入空气的目的是让氨挥发出来,从而使氧气和氨充分混合
B.瓶口出现少量红棕色气体,说明氨催化氧化的产物是NO2
C.瓶内有白烟出现是由于生成了白色晶体NH4NO3
D.铂丝保持红热说明该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是
2NH3。下列有关说法正确的是
A.达到化学反应最大限度时,正反应和逆反应的速率都为零
B.当符合:3正N2=正H2时,反应达到最大限度
C.达到化学最大限度时,单位时间消耗a mol N2,同时生成3a mol H2
D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到最大限度态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
‘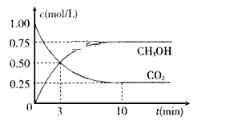
(1)该密闭容器的容积是______________L。
(2)达到平衡状态的时刻是_______________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=_____________mol/(L·min)。
(CO2)=_____________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为______。
(5)该温度下,反应的化学平衡常数数值是____。
(6)已知: ① CO(g)+2H2(g) ![]() CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g) ![]() CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____,反应在10 min内所放出的热量为_____kJ.
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____,反应在10 min内所放出的热量为_____kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后改变某一条件,下列说法正确的是( )
2NH3(g)△H<0,达到平衡后改变某一条件,下列说法正确的是( )
A. 升高温度,正反应速率减小,逆反应速率增大,平衡逆向移动
B. 升高温度可提高N2转化率
C. 增加H2的浓度,可提高N2转化率
D. 改用高效催化剂,可增大反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com