
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。LiCoO2是锂离子电池最早使用的电极材料,利用原钴矿(主要成分为Co2O3)制备LiCoO2的工艺流程如图:
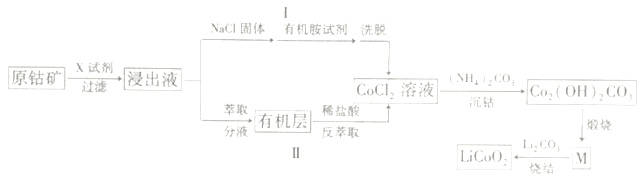
资料:在含一定量Cl-的溶液中,Co2+以CoCl42-形式存在:Co2++4C1-![]() CoCl42-
CoCl42-
(1)若“X试剂”是稀H2SO4和H2O2,则H2O2的作用是___。
(2)若“X试剂”是盐酸,写出离子反应方程式___。
(3)途径I中加入NaCl固体的目的___(用平衡移动原理解释)。
(4)“沉钴”过程中,为了提高Co2(OH)2CO3的产量,温度不宜过高的原因是___。
(5)已知M是钴的某种氧化物,63.6gCo2(OH)2CO3,煅烧成物质M时转移电子0.4mol,则M的化学式为___;写出“烧结”的化学方程式___。
(6)取mg样品溶于稀硫酸,加入过量KI溶液,再用cmol·L-1Na2S2O3标准液滴定(淀粉溶液做指示剂),达到滴定终点时,消耗Na2S2O3溶液VmL,则产品中钻元素的百分含量为___。
(有关反应:LiCoO2+4H+=Li++Co3++2H2O,2Co3++2I-=2Co2++I2,I2+2S2O32-=S4O62-+2I-)
【答案】作还原剂 Co2O3 +6H+ + 2Cl- = 2Co2++Cl2↑+ 3H2O 加入NaCl固体,溶液中C1-浓度增大,平衡Co2++4C1-![]() CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度 温度过高,碳酸铵分解,碳酸铵浓度降低,沉淀质量减少 Co3O4 4Co3O4+6Li2CO3+O2
CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度 温度过高,碳酸铵分解,碳酸铵浓度降低,沉淀质量减少 Co3O4 4Co3O4+6Li2CO3+O2![]() 12LiCoO2 +6CO2
12LiCoO2 +6CO2 ![]()
【解析】
原钴矿(主要成分为Co2O3)与稀硫酸和双氧水发生氧化还原反应生成硫酸钴和水,Co2+溶液中加入NaCl固体,致使溶液中氯离子浓度增大,平衡正向移动,洗脱得到CoCl2溶液,加入碳酸铵生成Co2(OH)2CO3,Co2(OH)2CO3在空气中煅烧生成Co3O4,Co3O4和碳酸锂烧结生成LiCoO2。据此解答。
(1)若“X试剂”是稀H2SO4和H2O2,Co2O3与稀H2SO4和H2O2反应生成Co2+,钴化合价降低,则化合价升高H2O2,因此H2O2的作用是作还原剂;故答案为:作还原剂。
(2)若“X试剂”是盐酸,Co2O3与HCl发生氧化还原反应,其离子反应方程式Co2O3 +6H+ + 2Cl- = 2Co2++Cl2↑+ 3H2O;故答案为:Co2O3 +6H+ + 2Cl- = 2Co2++Cl2↑+ 3H2O。
(3)根据图中信息Co2+以CoCl42形式存在:Co2++4C1-![]() CoCl42,因此途径I中加入NaCl固体的目的加入NaCl固体后溶液中C1-浓度增大,平衡Co2++4C1-
CoCl42,因此途径I中加入NaCl固体的目的加入NaCl固体后溶液中C1-浓度增大,平衡Co2++4C1-![]() CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度;故答案为:加入NaCl固体,溶液中C1-浓度增大,平衡Co2++4C1-
CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度;故答案为:加入NaCl固体,溶液中C1-浓度增大,平衡Co2++4C1-![]() CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度。
CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度。
(4)“沉钴”过程中,为了提高Co2(OH)2CO3的产量,温度不宜过高,主要是因为温度过高,碳酸铵分解,碳酸铵浓度降低,沉淀质量减少;故答案为:温度过高,碳酸铵分解,碳酸铵浓度降低,沉淀质量减少。
(5)已知M是钴的某种氧化物,63.6g Co2(OH)2CO3即物质的量为0.3 mol,则有+2价的钴0.6mol,煅烧成物质M时转移电子0.4mol,说明有0.4mol+2价钴升高变为+3价钴,还有0.2mol钴化合价未变,即得到M的化学式为Co3O4;因此“烧结”的化学方程式4Co3O4+6Li2CO3+O2![]() 12LiCoO2 +6CO2;故答案为:4Co3O4+6Li2CO3+O2
12LiCoO2 +6CO2;故答案为:4Co3O4+6Li2CO3+O2![]() 12LiCoO2 +6CO2。
12LiCoO2 +6CO2。
(6)根据方程式可得关系式LiCoO2~S2O32,得到n(Co) = cmol·L1×V×103L = cV×103mol,则产品中钴元素的百分含量为![]() ;故答案为:
;故答案为:![]() 。
。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
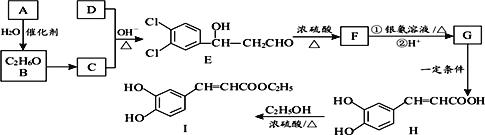
【题目】3,4―二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由化合物A制备该物质的合成路线如图:
已知:R—CHO+R’—CH2—CHO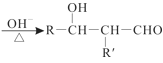
回答下列问题:
(1)A的结构简式为___,I中含氧官能团的名称是___。
(2)E生成F的反应类型为___。
(3)下列有关H的说法中,不正确的是___。
a.能使酸性高锰酸钾溶液褪色
b.1molH最多能和3molBr2反应
c.H分子中最多有9个碳原子共平面
d.1molH分别与足量NaOH、NaHCO3反应时,消耗的NaOH、NaHCO3的物质的量之比为1:1
(4)写出C+D→E的化学方程式___。
(5)已知W是H的同分异构体,符合下列条件的W结构共有___种。
①属于芳香族化合物。
②1molW与足量NaHCO3溶液反应生成气体44.8L(标准状况)。
其中,核磁共振氢谱有4组吸收峰,且峰面积比为1∶2∶2∶3的结构简式为:___(写一个即可)
(6)季戊四醇(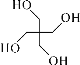 )是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)。合成路线的表示方法为:___。
)是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)。合成路线的表示方法为:___。
A![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2—苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A.不能使稀酸性高锰酸钾溶液褪色B.与甲苯互为同系物
C.最多能与4molBr2发生加成反应D.与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学与生产.生活相关的说法正确的是
A.生铁、青铜等合金比纯金属耐腐性强
B.石油主要由各种烃组成的混合物,可以通过分馏的方法分离出C8H18
C.分离工业合成氨产品的方法是将氨气液化
D.氨的催化氧化的适宜条件为高温、高压、催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物与人类生产、生活密切相关。
(1)已知:S(s)+O2(g)= SO2(g) ΔH1=-a kJ·mol-1
S(g)+O2(g)= SO2(g) ΔH2=- b kJ·mol-1
则a___(填“>”或“<”)b。
(2)在一定温度和压强下,将2molSO2和1molO2置于密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),并达到平衡。
2SO3(g),并达到平衡。
①若再加入1 molO2,该平衡向___(填“正”或“逆”)反应方向移动;
②若降低温度,达到平衡时测得SO2的含量减少,则正反应是___(填“吸热”或“放热”)反应;
③该反应的化学平衡常数表达式K=___。若只增大压强,则K__(填“增大”“减小”或“不变”)。
(3)常温下,现有0.5mol·L-1Na2SO3溶液,请判断:(Na2SO3第一步水解的离子方程式是SO32-+H2O![]() HSO3-+OH-)
HSO3-+OH-)
①该溶液的pH___(填“>”或“<”)7;
②该溶液中c(Na+)___(填“>”或“<”)2c(SO32-);
③盐类水解反应是吸热反应。加热该溶液,SO32-的浓度将__(填“增大”或“减小”)。
(4)如图是电解硫酸铜溶液的装置。
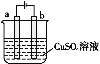
①若a、b为石墨电极,b电极的质量增加,写出该极的电极反应式:___;
②电镀是电解原理的一种重要应用。若利用该装置在铁件上镀铜,则铁件应与电源的__ (填“正极”或“负极”)连接。
(5)已知硫酸钡的沉淀溶解平衡为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸钡的饱和溶液中Ba2+的浓度为____mol·L-1。
Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸钡的饱和溶液中Ba2+的浓度为____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃下,在一容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g) 。下列各物理量随反应时间变化趋势的曲线不正确的是
CH3OH(g) 。下列各物理量随反应时间变化趋势的曲线不正确的是
A. 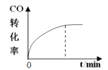 B.
B. 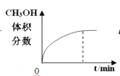
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的密闭容器中发生反应:C(s)+H2O(g) ![]() CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
A. 容器内CO的物质的量分数保持不变B. 容器内体系的压强保持不变
C. 容器内气体的密度保持不变D. 单位时间内消耗1molH2O(g),同时生成1molCO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。向20mL0.1mol·L-1BaCl2溶液中滴入0.1mol·L-1的Na2SO4溶液,溶液中pBa2+[pBa2+=-lgc(Ba2+)]与Na2SO4溶液体积的关系如图所示。下列叙述错误的是( )

A.图像中,n=1,m=5
B.若起始时c(BaCl2)=0.2mol·L-1,m不变,b点向d点移动
C.若用同浓度的Na2CO3溶液替代Na2SO4溶液,可使b点向c点移动
D.V。时,向溶液中滴加Na2CO3溶液,产生BaCO3沉淀的条件是![]() >10
>10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)请写出Z-的的离子结构示意图_____________。
(2)请写出Z单质溶于X2Y中发生反应的离子方程式_____________。
(3)请写出Z单质与NaOH反应的化学方程式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com