
【题目】装有 Fe2O3、 CuO、 Fe、 Cu 的烧杯中加入过量稀硫酸,充分反应后,仍有红色粉末剩余,则关于反应后溶液中金属阳离子的判断一定正确的是
A. 一定有Fe2+,可能有Cu2+ B. 只有Fe2+
C. 一定有Fe2+、Cu2+,可能有Fe3+ D. 只有Fe2+和Fe3+
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下一定能大量共存的是
A. 能使pH试纸变红的溶液中:SO32-、S2-、K+、Na+
B. 由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:Mg2+、Na+、Br-、ClO-
C. 在c(OH-)/c(H+)=1×10-10的溶液中:NH![]() 、Ca2+、Cl-、NO
、Ca2+、Cl-、NO![]()
D. 含有大量Fe3+的溶液:CO![]() 、I-、K+、Br-
、I-、K+、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl的质量分别
A. 1000mL,117gB. 950mL,111.2 g
C. 任意规格,117gD. 500mL,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5 次氯酸 K=2.95×10-8
碳酸 K1=4.0×10-7 K2=5.0×10-11
亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)常温下,写出碳酸的第一级电离平衡常数表达式K1=__________,则0.50mol/L的Na2CO3溶液的pH=________
(2)等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为_____________。
(3)向0.01molL-1CH3COONa溶液中分别加入少量浓盐酸、Na2CO3固体使水解平衡移动的方向分别为___________、________.(填“左”“右”或“不移动”)
(4)物质的量浓度均为0.1 mol/L的CH3COONa和CH3COOH溶液等体积混合混合液中的下列关系式正确的是________。
A.c(CH3COOH)+2c(OH-)=c(CH3COO-)+2c(H+)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.2mol/L
D. c(CH3COOH) > c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
(5)下列离子方程式中错误的是________。
A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO![]() +HClO
+HClO
B.少量SO2通入次氯酸钙溶液中:2ClO-+SO2+H2O===SO32-+2HClO
C.Na2CO3溶液中加入足量NaHSO3溶液: CO32-+HSO3-=HCO3-+SO32-
D.少量CO2通入亚硫酸钠溶液中: SO32-+CO2+H2O=HSO3-+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素.它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z既能形成离子化合物,又能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y>Z
C. Z、W元素的最简单氢化物的沸点和稳定性均为H2Z>H2W
D. X与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如下图所示的实验,每次实验所加试剂均过量。已知稀HNO3具有强氧化性。下列说法不正确的是( )

A. SO42-、SO32-至少含有一种 B. 沉淀B的化学式为 BaCO3
C. 肯定存在的阴离子有 CO32-、HCO3-、Cl- D. Br—肯定不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,c(Ag+)由大到小的顺序为:_________。
(2) 含有Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() 。为了使废水的排放达标,进行如下处理:Cr2O
。为了使废水的排放达标,进行如下处理:Cr2O![]()
![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH3)、Fe(OH)3
Cr(OH3)、Fe(OH)3
(a) 该废水中加入绿矾和H+,发生反应的离子方程式为__________________。
(b) 若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为_____
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
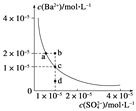
(a) 下列说法正确的是________(填序号)。
A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点
B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(b) 将100 mL 1 mol·L-1 H2SO4溶液加入100 mL含Ba2+ 0.137 g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com