
25 ℃时,水的电离达到平衡:H2O H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是
A.向水中加入少量固体NaHSO4,c(H+)增大,KW不变
B.向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低
C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
科目:高中化学 来源:2014-2015陕西省西安市高二上学期期末化学试卷(解析版) 题型:填空题
(12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验 编号 | HA物质的量 浓度(mol·L-1) | NaOH物质的量 浓度(mol·L-1) | 混合溶 液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组实验分析,HA是________(填“强酸”或“弱酸”)。
(2)②组实验表明,c________0.2(填“大于”、“小于”或“等于”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是__________________。
(3)从③组实验结果分析,说明HA的电离程度______(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是_______________________。
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)- c(HA)=_________mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏徐州市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列有关碳酸钠和碳酸氢钠性质的说法中正确的是
A.25℃时,碳酸氢钠在水中的溶解度比碳酸钠的小
B.用澄清石灰水能将碳酸钠溶液和碳酸氢钠溶液区别开来
C.加热时,碳酸钠、碳酸氢钠固体均能反应并都生成二氧化碳气
D.常温下,浓度均为0.l mol.L-1溶液的pH大小:NaHCO3 >Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二第一学期化学试卷(解析版) 题型:填空题
(14分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子最外层电子排布为3s23p1,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)则W为 ,X为 ,Y为 ,Z为 。(填元素符号)
W的气态氢化物稳定性比H2O(g) (填“强”或“弱”)。
(2)Z原子的基态原子核外电子排布式是 ,Y的电负性比X的________(填“大”或“小”),W的第一电离能比O的 (填“大”或“小”)。
(3)X的最高价氧化物对应水化物与NaOH溶液反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二第一学期化学试卷(解析版) 题型:选择题
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀上滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
A.白色沉淀为ZnS,而黑色沉淀为CuS
B.利用该原理可实现一种沉淀转化为更难溶的沉淀
C.该过程破坏了ZnS的溶解平衡
D.上述现象说明ZnS的Ksp小于CuS的Ksp
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:填空题
(14分)Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是____________________。
(2)为便于储存,要将氯气液化[ Cl2(g)  Cl2(l) ],应采取的措施是_____(写出一条即可)。
Cl2(l) ],应采取的措施是_____(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
危险性 |
|
储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
包装 | 钢瓶 |
① 用离子方程式表示“泄漏处理”中NaHSO3溶液的作用_______。
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③ 氯气含量检测仪工作原理示意图如下图甲所示,则Cl2在Pt电极放电的电极反应式是_______。

(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如上图乙所示:
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:选择题
某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系的比较正确的是
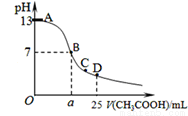
A.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
B.在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
D.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省怀化市小学课改高二上学期期末化学试卷(解析版) 题型:填空题
(每空2分,共16分)
I、恒温下,将a mol N2与b mol H2的混合气体通入一个固体容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)  2NH3(g)
2NH3(g)
(1)该反应的平衡常数表达式为:K=
(2)若反应进行到某时刻t时,nt(N2)=8 mol,nt(NH3)=4 mol,计算 a= 。当反应达到平衡时,混合气体的体积为537.6 L(标况下),其中NH3的含量(体积分数)为25%。原混合气体中, a:b= 。
Ⅱ、反应mA+nB pC+qD在某温度下达到平衡。
pC+qD在某温度下达到平衡。
①若A、B、C 、D都是气体,保持温度不变,将气体体积压缩到原来的一半,当再次达到平衡时C的物质的量浓度变为原来的1.6倍,则m、n、p、q的关系是m+n p+q(填“<”或“>”或“=”) 。
②若A、B、C ,D都为气体,且m+ n = p+q,则将气体体积压缩后A的物质的量将 _________(填“减小”“增大”“不变”),平衡______移动。(填“正向”或“逆向”或“不”)
③若给体系升温,B的物质的量减少,则正反应为 ________反应(填“放热”或“吸热”)
④若在体系中增加A的量,平衡不发生移动,则A肯定不能为_____态。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末化学试卷(解析版) 题型:选择题
下列反应能用CO32- + 2H+ = CO2 ↑ + H2O表示的是
A.Na2CO3 + H2SO4= Na2SO4+ CO2 ↑ + H2O
B.CaCO3 + 2HCl =CaCl2 + CO2 ↑+ H2O
C.KHCO3 + HCl = KCl + CO2 ↑ + H2O
D.BaCO3 + 2HNO3 =Ba(NO3 )2+ CO2 ↑ + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com