
(12分)【化学——物质结构与性质】
A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
(3) DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式
为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,
两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,
该配位化合物X的化学式为_________。
(6) Sb的一种氧化物高于843K时会转化为长链的大分子,
其结构片段如图,则该分子中Sb和O的原子个数比为_______ 。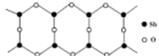
(12分)
(1)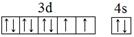 (2分)
(2分)
(2)S<O<N (2分)
(3)sp3 (2分)
(4)H2O与H2O2之间形成氢键(2分)
(5)[Ni(NH3)6]SO4(2分)
(6)2∶3(2分)
解析试题分析:B元素原子最外层电子数比内层多3个,则B为N元素;C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则E为Ni元素。
(1)E为Ni元素,基态原子的外围电子排布图为: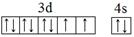
(2)元素B、C、D分别为N、O、S,N原子2p能级排布了3个电子,为半充满状态,较稳定,第一电离能大于O,所以第一电离能由小到大排列顺序为:S<O<N
(3)DC3冷凝可形成一种D、C相间的六元环结构的三聚体,则六元环上3个S和3个O依次交替,每个S再连接2个O,则每个S形成4个σ键,所以S原子的杂化方式为sp3
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,则A为H元素,两种化合物分别为H2O、H2O2,H2O与H2O2之间形成氢键,所以两种化合物可任意比互溶。
(5)A、B、C、D、E五种元素组成某配位化合物X,根据其原子个数比为18:6:4:1:1,可得化学式为:[Ni(NH3)6]SO4
(6)根据切割法,Sb位于公共边上,所以1个环含有Sb:4×1/2=2;位于上下顶点上的O只属于1个环,位于公共边上的O为2个环共用,所以1个环含有O:2×1/2+2=3,因此该分子中Sb和O的原子个数比为2:3。
考点:本题考查元素的推断、第一电离能、杂化方式、氢键、切割法的计算。


科目:高中化学 来源: 题型:填空题
(4分)(1)写出表示含有8个质子、10个中子、10个电子的离子的符号 。(写成ZAXn-的形式)
(2)周期表中位于第8纵行的铁元素属于第 族。
(3)周期表中最活泼的非金属元素位于第 纵行 族。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是_____。
(2)XY2-离子的立体构型是_______;R2+的水合离子中,提供孤电子对的是原子是______。
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数之比是___________。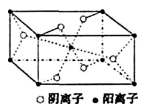
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
《物质结构与性质》
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
⑴判断离子AB2-离子的空间构型为 。
⑵元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是 。
⑶在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 。
⑷元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为 。
⑸向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的外围电子排布式为 。
②1 mol该配合物中含配位键的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有 种不同能量的电子,这些电子分占 种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)(2012?山东)[化学﹣物质结构与性质]金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是 .
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 .
(3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .CO与N2结构相似,CO分子内σ键与π键个数之比为 .
(4)甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为 ,甲醇分子内的O﹣C﹣H键角 (填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3?10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
| | 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
(1)写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
(2)下列能说明碳与硫两元素非金属性相对强弱的是 。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(3)羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式 ,负极的反应产物为 (填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:COS + H2 CO + H2S
CO + H2S
(4)已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K ,反应速率 (均选填“增大”、“减小”、“不变”)。
(5)若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是 。
a.容器内气体密度保持不变 b.容器内温度保持不变
c.c(H2)=c(H2S) d.υ(H2)正=υ(H2S)正
(6)已知该反应的平衡常数很大,说明 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com