
(4分)(1)写出表示含有8个质子、10个中子、10个电子的离子的符号 。(写成ZAXn-的形式)
(2)周期表中位于第8纵行的铁元素属于第 族。
(3)周期表中最活泼的非金属元素位于第 纵行 族。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
现有四种短周期元素X、Y、Z、W,它们的原子序数依次增大。其中:①X原子是元素周期表中原子半径最小的;②Y的L层电子是K层电子的2倍;③Z的最外层电子是内层电子的3倍;④W与X同主族。请回答下列问题:
(1)X的元素符号为 ,Y在周期表中的位置是 ,
Z单质的化学式为 。
(2)X与Z组成的含有非极性共价键的化合物的分子式为 ;化合物W2Z2的电子式为 。
(3)向Na2SiO3的溶液中缓慢通入过量的YZ2,反应的离子方程式是 ;分子中有10个电子,则X与Z组成的分子为 、X与Y组成的分子式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)下表是元素周期表的一部分: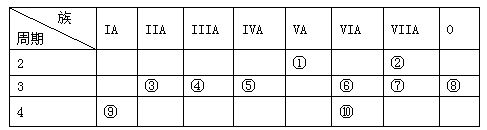
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是 ,非金属性最强的元素是 。
(2)化学性质最不活泼的元素是 ,其原子结构示意图为 。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是 。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是 。
(5)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据元素周期表,填写下列空白:
(1)最活泼的非金属元素位于周期表中第 周期第 族、第 纵行。某元素B含有8个质子、10个中子,用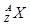 表示B原子的组成 ,
表示B原子的组成 ,
(2)在第三周期中,A、C两元素的原子序数之差为4,它们组成化合物AC的化学式为_____
(3)1mol某物质含有不同周期的三种元素各1mol,其核电荷总数为20mol,该物质的化学式为 ;它是 化合物(离子或共价)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: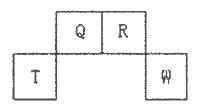
(l)W在周期表中的位置是___________,Q、R、T三种元素原予的半径从大到小排列顺序为 (用元素符号表示),Q的最高价氧化物的电子式___________,R气态氢化物分子的结构式为___________;
(2)元素的原子得电子能力:Q_____W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点___________(填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是___________(填名称);
(5)现有8种属于短周期的元素,它们的性质、数据如下表所列。请指出R元素在下表中的对应编号___________,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
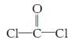 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
| 族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | | | | ① | ② | | ③ | |
| 三 | | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。 请回答下列问题:
(1)这四种元素中电负性最大的是 (填元素符号)、第一电离能最小的是 (填元素符号);
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式);
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为 ;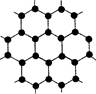
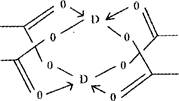
(4)D的醋酸盐晶体局部结构如右图,该晶体中含有的化学键是 (填选项序号);
①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
第①步产生的棕色的烟属于 (填一种分散系),如第②步加大量水,溶液呈 色,
写出第⑤步反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)【化学——物质结构与性质】
A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
(3) DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式
为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,
两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,
该配位化合物X的化学式为_________。
(6) Sb的一种氧化物高于843K时会转化为长链的大分子,
其结构片段如图,则该分子中Sb和O的原子个数比为_______ 。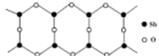
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com