
《物质结构与性质》
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
⑴判断离子AB2-离子的空间构型为 。
⑵元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是 。
⑶在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 。
⑷元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为 。
⑸向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的外围电子排布式为 。
②1 mol该配合物中含配位键的数目为 。
⑴V形
⑵两种化合物均为原子晶体,Si—O键键能大于Si—N键
⑶sp3
⑷CrO2
⑸①3d3 ②6NA
(每空2分,共12分)
解析试题分析:A、B、C、D分别为N、O、Si、Cr。(1)NO2-中氮原子价电子对数为(5+1)÷2=3,为sp2杂化,空间结构为V形;(2)氮化硅和二氧化硅均为原子晶体,熔沸点高低与键能有关,半径小,键能大,熔沸点高;(3)化合物N2H4氮原子与氢原子形成单键,为sp3杂化;(4)晶胞中Cr为8×1/8+1=2,O为4×1/2+2=4,化学式为CrO2;(5)配合物中氨气、水、氯离子均与铬原子形成1个配位键,故1 mol该配合物中含配位键的数目为6NA。
考点:考查STS中环境保护有关问题。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
根据元素周期表,填写下列空白:
(1)最活泼的非金属元素位于周期表中第 周期第 族、第 纵行。某元素B含有8个质子、10个中子,用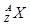 表示B原子的组成 ,
表示B原子的组成 ,
(2)在第三周期中,A、C两元素的原子序数之差为4,它们组成化合物AC的化学式为_____
(3)1mol某物质含有不同周期的三种元素各1mol,其核电荷总数为20mol,该物质的化学式为 ;它是 化合物(离子或共价)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。 请回答下列问题:
(1)这四种元素中电负性最大的是 (填元素符号)、第一电离能最小的是 (填元素符号);
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式);
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为 ;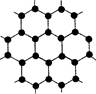
(4)D的醋酸盐晶体局部结构如右图,该晶体中含有的化学键是 (填选项序号);
①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
第①步产生的棕色的烟属于 (填一种分散系),如第②步加大量水,溶液呈 色,
写出第⑤步反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)X、Y、Z、D、E、W是原子序数依次递增的短周期主族元素。
(1)Y元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,该反应的化学方程式为________________________________;Y与氢原子按个数比1:2形成的含18个电子的化合物的电子式为________________。
(2)X、E同主族,纯净的单质E可用于制太阳能电池,则X在周期表中的位置是________________;X与E作电极,同NaOH溶液可构成原电池,则该电池负极的电极反应式为:______________ 。
(3)常温常压下,W的单质为气体,且常用于自来水的消毒,W的一种氧化物W2O是酸性氧化物,W2O与水反应的方程式为______________ __________________,W2O的结构式为_____________。
(4)Z、D、E、W同周期,D的简单离子半径是同周期简单离子中半径最小的, D的单质与Z的最高价氧化物对应水化物反应的离子方程式为________________________________。
(5)(XY)2与W2性质相似,则(XY)2分子中含有的化学键有_____________________(填“离子键”、“极性键”或“非极性键”);(XY)2的制备原理同实验室制取W2类似,在酸性条件下用MnO2氧化对应的阴离子得到。写出制取(XY)2的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)决定物质性质的重要因素是物质结构。请回答下列问题:
(1)铜是过渡元素。化合物中,铜常呈现+1价或+2价。右图为某铜氧化物晶体结构单元,该氧化物的化学式为 。
(2)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)【化学——物质结构与性质】
A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
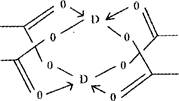
(3) DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式
为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,
两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,
该配位化合物X的化学式为_________。
(6) Sb的一种氧化物高于843K时会转化为长链的大分子,
其结构片段如图,则该分子中Sb和O的原子个数比为_______ 。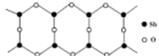
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,最高价氧化物的水化物的碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为 、 ,原子半径最大的金属元素的名称是 ,离子半径最小的离子结构示意图是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
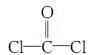 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com