
【题目】已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物, B溶于水得蓝色溶液,E为红棕色粉末,它们有如下图所示的关系(反应中生成的水已略去)。

试回答下列问题。
(1)推断填写物质化学式:A是________ ,D是_________,E是_________,H是_________。
(2)F的类别是_________(选填“酸性氧化物”、“碱性氧化物”或“两性氧化物”)。
(3)反应④的化学方程式为___________________________________________。
【答案】 Cu AlCl3 Fe2O3 FeCl3 两性氧化物 2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
【解析】已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物,B溶于水得蓝色溶液,所以A是铜,与氯气反应生成B是氯化铜。E为红棕色粉末,E是氧化铁C与氧化铁反应生成G和F,则根据反应条件高温可判断反应④是铝热反应,所以C是Al,G是铁,F是氧化铝,与盐酸反应生成D是氯化铝,铝与氯化铜发生置换反应生成铜和氯化铝。铁UI氯气化合生成H是氯化铁,遇KSCN溶液显红色。
(1)根据以上分析可知A是Cu,D是AlCl3,E是Fe2O3,H是FeCl3。(2)氧化铝属于两性氧化物。(3)反应④的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。
Al2O3+2Fe。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知![]() 在酸性溶液中易被还原成
在酸性溶液中易被还原成![]() ,且
,且![]() 、
、![]() 、
、![]() 、
、![]() 的氧化性依次减弱。下列叙述中,正确的是
的氧化性依次减弱。下列叙述中,正确的是
A. ![]() 通入
通入![]() 溶液中,可存在反应3
溶液中,可存在反应3![]() +6
+6![]() ====2
====2![]() +4
+4![]()
B. 每1 mol ![]() 在酸性溶液中被氧化生成
在酸性溶液中被氧化生成![]() 时转移2 mol
时转移2 mol ![]()
C. ![]() 溶液能将KI溶液中的I-氧化
溶液能将KI溶液中的I-氧化
D. I2具有较强的氧化性,可以将![]() 氧化成
氧化成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯气通入水中: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向苯酚浊液中滴加Na2CO3溶液:2C6H5OH+CO32-=2C6H5O-+H2O+CO2↑
C. 向偏铝酸钠溶液中加入NaHCO3溶液: AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
D. 碳酸氢铵溶液中加入足量NaOH溶液共热: NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如右图所示(EMI+为有机阳离子)。

①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH1=a kJ·mol-1
②3AlCl(g)===2Al(l)+AlCl3(g) ΔH2=b kJ·mol-1
③Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3
下列说法正确的是( )
A. ΔH3<0
B. Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3=(a-b) kJ·mol-1
C. 该电池充电时石墨电极与电源负极相连
D. 该电池放电时的负极反应方程式为Al-3e-+7AlCl===4Al2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种红棕色金属氧化物,B、D是常见的金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的化学式:A:_________I:_________J:_________G:_________;
(2)按要求写出下列反应的方程式
C→I的离子方程式:_____________________________________
F→G的化学方程式:_____________________________________
(3)将一定量A和C混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:

①混合物中含A的质量为______________;
②所用硫酸溶液物质的量浓度为___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |

(1)制备NaN3:
30℃时,水合肼(N2H4H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2)测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I- ![]() I2
I2 ![]() S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_________nm.
(3)中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是____________。
(4)我国早在春秋战国就开始生产和使用铁器,写出工业上用赤铁矿为原料炼铁的化学方程式:_______________________________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下某二元酸发生如下电离:H2A=H++HA-;HA-![]() H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
A. NaHA溶液呈酸性,因为HA-的电离程度大于水解程度
B. 常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的108倍
C. 常温下pH=2的H2A溶液中c(A2-)小于c(HA-)
D. 0.1mol/LH2A溶液中c(A2-)+c(HA-)+c(H2A)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶无色溶液,其中可能含有Al3+、Fe2+、Mg2+、Ba2+、K+、Cl-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:
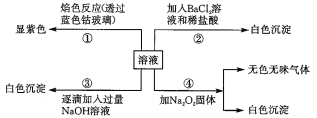
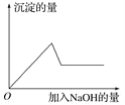
第③个实验中,生成白色沉淀的量与加入NaOH的量有如图所示的相互关系。据此可知:
(1)在原溶液中一定不存在的离子有______________;不能确定是否存在的离子有________。
(2)写出第③个实验中依次发生反应的离子方程式:___________、____________、______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com