
����Ŀ����һƿ��ɫ��Һ�����п��ܺ���Al3����Fe2����Mg2����Ba2����K����Cl����SO42���������еļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�������ĸ�ʵ�飬��������й��������£�
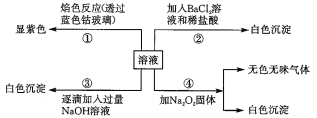
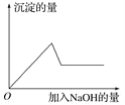
�ڢ۸�ʵ���У����ɰ�ɫ�������������NaOH��������ͼ��ʾ�����ϵ���ݴ˿�֪��
(1)��ԭ��Һ��һ�������ڵ�������______________������ȷ���Ƿ���ڵ�������________��
(2)д���ڢ۸�ʵ�������η�����Ӧ�����ӷ���ʽ��___________��____________��______��
���𰸡�Fe2����Ba2�� Cl�� Mg2����2OH��===Mg(OH)2�� Al3����3OH��===Al(OH)3�� Al(OH)3��OH��===AlO2����2H2O
��������
��Һ��ɫ����Fe2+(dz��ɫ)һ�������ڣ���ɫ��Ӧ����ɫ��˵��һ����K+��ʵ����м��������ữ���Ȼ�����Һ������ɫ������˵��һ����SO42������Ba2+һ�������ڣ���ʵ����Լ�ͼ���֪�����������ƺ������ɫ�������ﵽ���ֵ�������ʼ���٣�������ȫ��ʧ��һ����Mg2+��Al3+����Cl��ͨ�������ĸ�ʵ����ȷ�����ݴ˽��
��1��������������֪����ԭ��Һ��һ�������ڵ�������Fe2����Ba2����һ�����ڵ�������Al3+��Mg2+��K+��SO42��������ȷ���Ƿ���ڵ�������Cl����
��2����ԭ��Һ�д���Al3+��Mg2+���ӣ�������������������Һʱ��������������þ���������������������������������ܽ�������������ƫ�����ƣ������Һ�з�����Ӧ�����ӷ���ʽΪMg2++2OH����Mg(OH)2����Al3++3OH����Al(OH)3����Al(OH)3+OH����AlO2��+2H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��H����ѧ��ѧ�еij������ʣ�A��C��G�ǽ�����E��F������� B����ˮ����ɫ��Һ��EΪ����ɫ��ĩ������������ͼ��ʾ�Ĺ�ϵ����Ӧ�����ɵ�ˮ����ȥ����

�Իش��������⡣
��1���ƶ���д���ʻ�ѧʽ��A��________ ��D��_________��E��_________��H��_________��
��2��F�������_________��ѡ��������������������������������������
��3����Ӧ�ܵĻ�ѧ����ʽΪ___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ĸ������ʾ�йص�һ�ַ�Ӧ���������(ijЩ�����Ѿ���ȥ)�����г�����A��C��DΪ��ɫ���壬C��ʹʪ��ĺ�ɫʯ����ֽ������

��1��д�����и����ʵĻ�ѧʽ��
X��________��F��_______��
��2��д�����б仯�ķ�Ӧ����ʽ��
A��D��____________________��
C��E��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ᴿ��������Ba(NO3)2���ʵ�KNO3��Һ����ʹ�õķ���Ϊ( )
A.�������Na2CO3��Һ�����ˣ���ȥ��������Һ�в�����������
B.�������K2SO4��Һ�����ˣ���ȥ��������Һ�в�����������
C.�������Na2SO4��Һ�����ˣ���ȥ��������Һ�в�����������
D.�������K2CO3��Һ�����ˣ���ȥ��������Һ�в�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ǷŴ��˵ط�����Դ����Ӧ����������á������з��������ϴ�����ֽ��������Ʒ������
A. ���� B. ��� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij��H3Aˮ��Һ�к�A�ĸ������ӵķֲ�����(ƽ��ʱij�����ӵ�Ũ��ռ������Ũ��֮�͵ķ���)��pH��ϵͼ������ʾ������˵����ȷ����
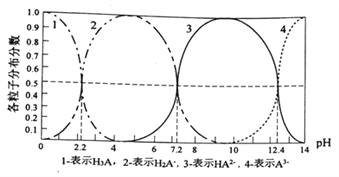
A. NaH2Aˮ��Һ�ʼ���
B. H3A��Һ�д���:c(H+)=c(OH-)+c(H2A-)+![]() c(HA2-)+
c(HA2-)+![]() c(A3-)
c(A3-)
C. ��H3A��Һ�м���һ������NaOH��Һ��pH=5ʱ��![]()
D. ��H3A��Һ�м��백ˮʹPH��5��9��������Ҫ���ӷ�Ӧ��:H2A-+OH-=HA2-+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����ࡢ��Ч����Դ��Ҳ����Ҫ�Ļ���ԭ�ϡ�
(1)��ҵ�����ü����Ʊ������ķ�ӦΪ:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
��֪:
��H2(g)+![]() O2(g)=H2O(g) ��H1=-198kJ/mol
O2(g)=H2O(g) ��H1=-198kJ/mol
��2CO(g)+O2(g)=2CO2(g) ��H2=-576kJ/mol
��CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H3=-846.3kJ/mol
��CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H4=________��
CO(g)+3H2(g) ��H4=________��
(2)��ҵ������CO��H2�ϳ������ԴCH3OH,�䷴ӦΪ:CO(g)+2H2(g)![]() CH3OH(g) ��H=-116kJ/mo1
CH3OH(g) ��H=-116kJ/mo1
����ͼ��ʾCO��ƽ��ת����(��)���¶Ⱥ�ѹǿ�仯��ʾ��ͼ��X��ʾ����_______������_________��Y1_____Y2 (�<������=������>��)��
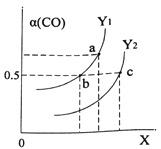
����2L�����ܱ������г���2molCO��4molH2����һ�������¾���10min�ﵽƽ��״̬c �㴦�����ڸ������£��ӿ�ʼ���ﵽƽ��״̬v(CH3OH)=________��ƽ�ⳣ��Ka��Kb��Kc�Ĵ�С��ϵ:____________��
�����д�ʩ��������Ӧ����������߷�Ӧ���ת���ʵ���_______��
A.ʹ�ô��� B.��ʱ����CH3OH C.�����¶� D.����ѹǿ
(3)��֪ȼ�ϵ�صı������뵥λ����ȼ������ʧȥ�ĵ����������ȡ�������H2��CH4��CH3OH�ļ��Ե�صı�������С�����˳��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. ����ʯ��ˮ�����̼��������Һ��Ӧ��![]() +Ca2++OH��=CaCO3��+H2O
+Ca2++OH��=CaCO3��+H2O
B. ����������Һ�м�������������Һ�����ԣ�H++![]() +Ba2++OH��=BaSO4��+2H2O
+Ba2++OH��=BaSO4��+2H2O
C. ������������Һ��ͨ������CO2��2OH��+CO2=![]() +H2O
+H2O
D. ������������Һ�м���������2H++![]() +Ba2++2OH��=BaSO4��+2H2O
+Ba2++2OH��=BaSO4��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ����Ǹ��л�ѧ���õ�������������������йؼ��㣺
(1)0. 6 g H2�к�����ԭ����Ϊ_________��
(2)��״���£�������ͬ��ԭ������CO��CO2�����֮��Ϊ____________��
(3)100mL��������Һ��n(Na+)=0.2mol��������c(SO42-)=_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com