
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_________nm.
(3)中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是____________。
(4)我国早在春秋战国就开始生产和使用铁器,写出工业上用赤铁矿为原料炼铁的化学方程式:_______________________________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________。
【答案】C 1-100 Fe3O4 Fe2O3+3CO![]() 2Fe+3CO2 2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-
2Fe+3CO2 2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-
【解析】
(1)根据元素的化合价处于中间价态,既能升高,又能降低,既有氧化性又有还原性;
(2)根据透明的红褐色是胶体,胶体的粒子直径1nm<d<100nm;
(3)四氧化三铁具有磁性;
(4)赤铁矿主要成分为氧化铁,被一氧化碳还原为铁;
(5)ClO-具有强氧化性,能够把+3价铁氧化为FeO42-,本身被还原为Cl-;
(1)铁元素有0价、+2价、+3价,+2价铁元素的化合价处于中间价态时,既能升高,又能降低, 所以FeSO4既有氧化性又有还原性;因此,本题正确答案是:C;
(2)因透明的红褐色分散系是胶体,胶体的粒子直径1nm<d<100nm;因此,本题正确答案是: 1-100。
(3)四氧化三铁具有磁性,能够吸引铁,天然磁石主要成分是Fe3O4;综上所述,本题答案是:Fe3O4。
(4)氧化铁与一氧化碳反应生成铁和二氧化碳,用赤铁矿为原料炼铁的化学方程式:Fe2O3+3CO![]() 2Fe+3CO2 ;综上所述,本题答案是:Fe2O3+3CO
2Fe+3CO2 ;综上所述,本题答案是:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(5) ClO-具有强氧化性,能够把+3价铁氧化为FeO42-,本身被还原为Cl-,其反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-;综上所述,本题答案是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】在3S + 6KOH === 2K2S + K2SO3 + 3H2O的反应中,被氧化的硫和被还原的硫的质量比是
A. 2∶ 1 B. 2∶ 3 C. 1∶ 2 D. 3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( )
A.一定有SO42-
B.可能有SO42- 或Ag+
C.一定无Ag+
D.还可能有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物, B溶于水得蓝色溶液,E为红棕色粉末,它们有如下图所示的关系(反应中生成的水已略去)。

试回答下列问题。
(1)推断填写物质化学式:A是________ ,D是_________,E是_________,H是_________。
(2)F的类别是_________(选填“酸性氧化物”、“碱性氧化物”或“两性氧化物”)。
(3)反应④的化学方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用钒炉渣(主要含FeO·V2O5,还有少量SiO2、P2O5等杂质)提取V2O5的流程如下:

(1)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,该过程中被氧化的元素是_______________;浸出渣的主要成分为____________________(填化学式)。
(2)用MgSO4溶液除硅、磷时,滤渣的主要成分为__________。
(3)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示,210℃时,剩余固体物质的化学式为_____________________。

(4)由V2O5冶炼金属钒采用铝热法,引发铝热反应的实验操作是__________________.
(5)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,俯视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
②H2(g)+![]() O2(g)=H2O(g)△H2
O2(g)=H2O(g)△H2
③C(s)+O2(g)=CO2(g)△H3
④4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)△H4
下列说法不正确的是( )
A. △H4=12△H3+10△H2﹣2△H1
B. 若将①中 H2(g)改为 H2(l)则△H>△H1
C. C(金刚石,s)与 C(石墨,s)的燃烧热不同
D. △H2是 H2(g)的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出下列各物质的化学式:
X:________;F:_______。
(2)写出下列变化的反应方程式:
A→D:____________________;
C→E:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁、高效新能源,也是重要的化工原料。
(1)工业上利用甲烷制备氢气的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
已知:
①H2(g)+![]() O2(g)=H2O(g) △H1=-198kJ/mol
O2(g)=H2O(g) △H1=-198kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-846.3kJ/mol
则CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4=________。
CO(g)+3H2(g) △H4=________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) △H=-116kJ/mo1
CH3OH(g) △H=-116kJ/mo1
①如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_______,理由_________;Y1_____Y2 (填“<”、“=”、“>”)。
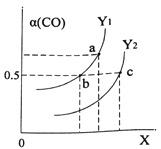
②在2L恒容密闭容器中充入2molCO和4molH2,在一定条件下经过10min达到平衡状态c 点处。则在该条件下,从开始至达到平衡状态v(CH3OH)=________,平衡常数Ka、Kb、Kc的大小关系:____________。
③下列措施既能增大反应速率又能提高反应物的转化率的是_______。
A.使用催化剂 B.及时分离CH3OH C.升高温度 D.增大压强
(3)已知燃料电池的比能量与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由小到大的顺序为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com