
往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:

⑴精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁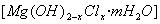 ,反应的化学方程式为 。
,反应的化学方程式为 。
⑵合成反应后,继续在393 K~523 K下水热处理8 h,发生反应:
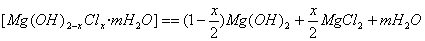
水热处理后,过滤、水洗。水洗的目的是 。
⑶阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是 。
⑷已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g); △H1=+81.5 kJ·mol-1
Al(OH)3(s)=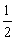 Al2O3(s)+
Al2O3(s)+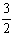 H2O(g); △H2=+87.7 kJ·mol-1
H2O(g); △H2=+87.7 kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,
原因是 。
⑸常用阻燃剂主要有 三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是 (填代号),理由是 。
三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是 (填代号),理由是 。
【答案】
⑴2MgCl2+(2-X)Ca(OH)2+2mH2O==2[Mg(OH)2-XClx ·mH2O]+(2-X)CaCl2
⑵除去附着在Mg(OH)2表面的可溶性物质MgCl2、CaCl2 等。
⑶表面处理。
⑷①Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳。
②Mg(OH)2 Mg(OH)2的吸热效率为:81.5kJ·mol-1/58g·mol-1=1.41 kJ·g-1
Al(OH)3的吸热效率为:87.7kJ·mol-1/78g·mol-1=1.12 kJ·g-1 等质量的Mg(OH)2比Al(OH)3吸热多。
⑸C 四溴乙烷、磷酸三苯酯沸点低,高温时有烟生成,且高温时受热分解产生有毒、有害的污染物。无机类阻燃剂Mg(OH)2和Al(OH)3无烟、无毒、腐蚀性小。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
列收集Cl2的正确装置时 。
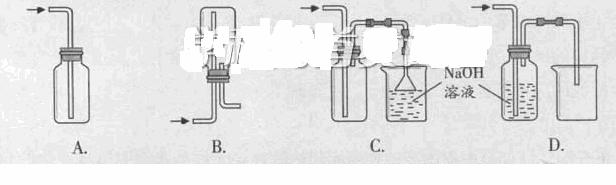
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 。
能量之间可以相互转化:点解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
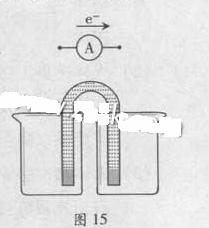 限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
完成原电池的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极。
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2: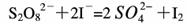
通过改变反应途径Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。________、___________(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为_____________。
证明炉渣中含有FeO的实验现象为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A: B : C: D :
(2)写出A、B、E三种微粒反应的离子方程式:
、
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中几种常见物质的转化关系如下:
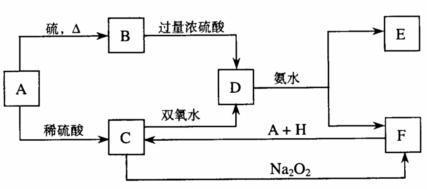
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:________________。
(2)A、B、H的化学式:A________、B________、H________。
(3)①H2O2分子的电子式:________________。
②写出C的酸性溶液与双氧水反应的离子方程式:
_____________________________________________________________________。
(4)写出鉴定E中阳离子的实验方法和现象:__________________________________________
_____________________________________________________________________。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应不能发生的是
A.CaCO3+2CH3COOH=(CH3COO)2Ca+H2O+CO2↑
B.SiO2+2NaOH=Na2SiO3+H2O
C.AgNO3+HCl=AgCl↓+HNO3
D.2HCl+Cu=CuCl2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L。
反应的化学方程式是__________________________________;样品中铝的质量是_______________g。
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:
_________________________,氧化铁与铝的质量比是_____________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c∶b=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X和Y是两种单质,它们之间的反应是X+Y==X2++Y2-,现有下列叙述:①X被氧化;②X是氧化剂;
③Y2-是还原产物;④X2+具有氧化性;⑤Y2-具有还原性;⑥Y单质的氧化性比X2+的氧化性强,在上述说法中正确的是( )。
A.①②③ B.①②⑥ C.①③④⑤⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
(1)纯铁比碳素钢易生锈 (2)用氨水除去试管上的银镜
(3)硅是制作光导纤维和制造太阳能电池的主要原料
(4)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性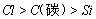
(5)催化剂只能改变反应的活化能,不能改变反应的热效应
(6)用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
(7)同主族元素的简单阴离子还原性越强,水解程度越大
(8)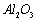 在工业上用于制作耐高温材料,也用于电解法治炼铝
在工业上用于制作耐高温材料,也用于电解法治炼铝
(9)丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
(10)明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视
A.(1)(4)(6)(7) B.(4)(6)(9)(10)
C.(3)(5)(6)(8) D.(5)(6)(8)(9)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com