
【题目】某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响。

已知:2NO2(g)![]() N2O4(g) ΔH=-52.7 kJ·mol-1
N2O4(g) ΔH=-52.7 kJ·mol-1
(1)该化学反应的浓度平衡常数的表达式为_______________。
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答:
①加入浓硫酸的烧杯中溶液温度________,A中的现象为____________________
②由上述实验现象可知,降低温度,该反应化学平衡向________(选填“正”或“逆”)反应方向移动。
③升高温度,该反应的化学平衡常数将________(选填“增大”“减小”或“不变”)。
【答案】K=![]() 升高 A中气体的颜色加深 正 减小
升高 A中气体的颜色加深 正 减小
【解析】
(1)根据平衡常数的表达式回答;
(2)①浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,反应2NO2(g)N2O4(g)是放热反应,A烧杯中,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,降低温度,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅;
②降低温度,该反应化学平衡移动,平衡向正反应方向移动;
反应是放热的,升高温度,平衡向逆反应方向移动,化学平衡常数减小。
(1)平衡常数的表达式K=C(N2O4)/C2(NO2),故答案为:K=C(N2O4)/C2(NO2)。
(2)①浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,反应2NO2(g)N2O4(g)是放热反应,A烧杯中,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,降低温度,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅;故答案为:升高;A中气体的颜色加深。
②降低温度,该反应化学平衡移动,平衡向正反应方向移动,故答案为:正。
③反应是放热的,升高温度,平衡向逆反应方向移动,化学平衡常数减小,故答案为:减小。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如下图所示,该流程同时获取副产物Fe2O3和MnCl2。

已知:I.过程①~④中,钨的化合价均不变;
Ⅱ.常温下钨酸难溶于水;
Ⅲ.25℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp [Mn(OH)2]=4.0×10-14
回答下列问题:
(1)上述流程中的“滤渣1”除MnO2外还有_____、“气体”除水蒸气、HCl外还有____(均填化学式);
(2)过程①中MnWO4参与反应的化学方程式为______;FeWO4参与的反应中氧化剂与还原剂的物质的量之比为___________;
(3)已知WO3(s)+3H2(g)=W(s)+3H2O(g) ΔH=a kJ·mol-1
WO3(s)=WO3(g) ΔH=b kJ·mol-1
写出WO3(g)与H2(g)反应生成W(s)的热化学方程式:_______;
(4)过程⑦在25℃时调pH,至少应调至_______(当离子浓度等于1.0×10-5mol·L-1时,可认为其已沉淀完全);
(5)过程⑧要获得MnCl2固体,在加热时必须同时采取的一项措施是__________;
(6)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0<x<1,这类化合物具有特殊的物理化学性质,是一种低温超导体。应用惰性电极电解熔融的Na2WO4和WO2混合物可以制备钠钨青铜,写出WO42-在阴极上放电的电极反应式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为1.0L的密闭容器中通入1.0 mol N2和x mol H2发生如下反应N2(g)+3H2(g)![]() 2NH3(g),20 min后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,容器内的压强变为原来的80%。请回答下列问题:
2NH3(g),20 min后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,容器内的压强变为原来的80%。请回答下列问题:
(1)20 min内,υ(N2)=____________________。
(2)该反应的热化学方程式为______________________________。
(3)下列叙述中能表示该反应达到平衡状态的是_________(填序号)。
①N2体积分数保持不变
②单位时间断裂0.3 mol H-H键,同时生成0.6 mol N-H键
③混合气体的密度不再改变
④2υ正(H2)=3υ逆(NH3)
⑤混合气体的平均摩尔质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,C和水在密闭容器中发生下列反应:C(s)+H2O(g)![]() CO(g)+H2(g),CO(g)+H2O(g)
CO(g)+H2(g),CO(g)+H2O(g)![]() CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为
CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为
A. 0.1 mol/L B. 0.9 mol/L C. 1.8 mol/L D. 1.9 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成除草剂苯达松和染料中间体X。
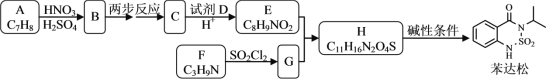
已知信息:①![]() +RCOOR′
+RCOOR′![]()
![]()
②RCH2COOR′+R′′COOR′′′![]()
![]()
(1)下列说法正确的是________。
A.化合物B到C的转变涉及到取代反应
B.化合物C具有两性
C.试剂D可以是甲醇
D.苯达松的分子式是C10H10N2O3S
(2)化合物F的结构简式是________。
(3)写出E+G→H的化学方程式________。
(4)写出C6H13NO2同时符合下列条件的同分异构体的结构简式________。
①分子中有一个六元环,且成环原子中最多含2个非碳原子;
②1HNMR谱和IR谱检测表明分子中有4种化学环境不同的氢原子。有N-O键,没有过氧键(-O-O-)。
(5)设计以CH3CH2OH和 原料制备X(
原料制备X( )的合成路线(无机试剂任选,合成中须用到上述①②两条已知信息,用流程图表示)________。
)的合成路线(无机试剂任选,合成中须用到上述①②两条已知信息,用流程图表示)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:

水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~-74 | 135~138 |
相对密度/(g·cm﹣3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用__________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的_______________________(填名称)。

(3)①中需使用冷水,目的是______________________________________。
(4)②中饱和碳酸氢钠的作用是_________________________________,以便过滤除去难溶杂质。
(5)④采用的纯化方法为____________。
(6)本实验的产率是_________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:

(1)在这些元素中,②位于元素周期表的第______纵行,④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(2)用电子式表示元素④与⑥的化合物的形成过程__________________________
(3)元素③的简单氢化物常温下和元素⑦的单质反应的离子方程式为__________________。
(4)④⑤⑥⑦的简单离子半径由小到大为___________________。(用元素符号表示)
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同
B.③的简单氢化物比⑥的简单氢化物稳定
C.③的简单氢化物的沸点比⑥的简单氢化物的沸点高
D.③的单质能与⑥的简单氢化物反应生成⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如图1所示:


已知:反应I和反应Ⅱ的平衡常数随温度变化曲线如图2所示:
(1)①写出反应I中的化学方程式是________________。
②若反应I在恒温恒压条件下,向体系中充入N2,乙醇的平衡转化率___(填“增大”、“减小”或“不变”),理由是___________。
(2)反应Ⅱ在进气比[n(CO):n(H2O)]不同,测得相应的CO的平衡转化率见下图3(各点对应的反应温度可能相同,也可能不同)。

①图中D、E两点对应的反应温度分别为TD和TE。判断:TD______________TE(填“<”“=”或“>”);
②当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___(用简要的文字叙述)。
(3)已知:
a、2CH3OH(g) + CO2(g) ![]() CO(OCH3)2(g) + H2O(g) △H = -15.5 kJ/mol,该反应在0 ℃时K≈10-4.5;
CO(OCH3)2(g) + H2O(g) △H = -15.5 kJ/mol,该反应在0 ℃时K≈10-4.5;
b、2CH3OH(g) + CO2(g) + ![]() (g)
(g) ![]() CO(OCH3)2(g) +
CO(OCH3)2(g) + ![]() (g)△H = -110.7 kJ/mol。依据以上数据,文献认为反应a没有工业价值,你认为其理由是______________________;但反应b引入环氧丙烷(
(g)△H = -110.7 kJ/mol。依据以上数据,文献认为反应a没有工业价值,你认为其理由是______________________;但反应b引入环氧丙烷(![]() )可有效促进CO2与CH3OH反应生成CO(OCH3)2,其原因是_________________________________。
)可有效促进CO2与CH3OH反应生成CO(OCH3)2,其原因是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com