
【题目】某研究小组拟合成除草剂苯达松和染料中间体X。
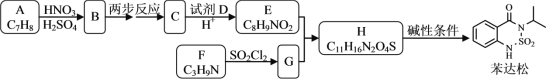
已知信息:①![]() +RCOOR′
+RCOOR′![]()
![]()
②RCH2COOR′+R′′COOR′′′![]()
![]()
(1)下列说法正确的是________。
A.化合物B到C的转变涉及到取代反应
B.化合物C具有两性
C.试剂D可以是甲醇
D.苯达松的分子式是C10H10N2O3S
(2)化合物F的结构简式是________。
(3)写出E+G→H的化学方程式________。
(4)写出C6H13NO2同时符合下列条件的同分异构体的结构简式________。
①分子中有一个六元环,且成环原子中最多含2个非碳原子;
②1HNMR谱和IR谱检测表明分子中有4种化学环境不同的氢原子。有N-O键,没有过氧键(-O-O-)。
(5)设计以CH3CH2OH和 原料制备X(
原料制备X( )的合成路线(无机试剂任选,合成中须用到上述①②两条已知信息,用流程图表示)________。
)的合成路线(无机试剂任选,合成中须用到上述①②两条已知信息,用流程图表示)________。
【答案】BC (CH3)2CHNH2 ![]() +(CH3)2CHNHSO2Cl
+(CH3)2CHNHSO2Cl![]() +HCl
+HCl ![]()
![]()

 CH3CH2OH
CH3CH2OH![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3![]() CH3COCH2COOCH2CH3
CH3COCH2COOCH2CH3

【解析】
以A和F为原料制备苯达松,观察苯达松结构简式,易知A中有苯环,便可推出A为 ,根据A到B的反应条件(HNO3和H2SO4)可知该反应为硝化反应,继续观察苯达松可知其苯环上为邻位二取代侧链,因而B为
,根据A到B的反应条件(HNO3和H2SO4)可知该反应为硝化反应,继续观察苯达松可知其苯环上为邻位二取代侧链,因而B为 ,继续观察苯达松侧链有羰基和亚氨基,说明B到C的两步反应为甲基被氧化为羧基和硝基被还原为氨基,C为
,继续观察苯达松侧链有羰基和亚氨基,说明B到C的两步反应为甲基被氧化为羧基和硝基被还原为氨基,C为 ,根据反应条件易知C和D反应为酯化反应,然后结合E的分子式可推出D是甲醇,E为
,根据反应条件易知C和D反应为酯化反应,然后结合E的分子式可推出D是甲醇,E为 ,最后结合苯达松右侧碳链部分和F的分子式可知氨基接在碳链中的2号碳上,F为
,最后结合苯达松右侧碳链部分和F的分子式可知氨基接在碳链中的2号碳上,F为![]() ,从而G为
,从而G为 。
。
(1)A.B到C的两步反应分别是甲基的氧化反应和硝基的还原反应,不涉及取代反应,A项错误;
B.C为邻氨基苯甲酸,其官能团为氨基和羧基,氨基具有碱性,羧基具有酸性,因而C有两性,B项正确;
C.C和D发生酯化反应生成E,结合C和E的分子式,易推出D为甲醇,C项正确;
D.苯达松的分子式是C10H12N2O3S,D项错误。
故答案选BC。
(2)结合苯达松右侧杂环上的碳链可知,氨基接在碳链中2号碳的位置,F的结构简式为(CH3)2CHNH2。
(3)G的氯原子和E氨基上的氢原子偶联脱去HCl生成H,因而化学方程式为![]() +(CH3)2CHNHSO2Cl
+(CH3)2CHNHSO2Cl![]() +HCl。
+HCl。
(4)根据分子式C6H13NO2算出不饱和度为1,结合信息,说明存在一个六元环,无不饱和键(注意无硝基)。结合环内最多含有两个非碳原子,先分析六元环:①六元环全为碳原子;②六元环中含有一个O;③六元环中含有一个N;④六元环中含有一个N和一个O;若六元环中含有2个O,这样不存在N-O键,不符合条件。同时核磁共振氢谱显示有4中氢原子,该分子具有相当的对称性,可推知环上最少两种氢,侧链两种氢,这种分配比较合理。最后注意有N-O键,无O-O键。那么基于上述四种情况分析可得出4种同分异构体,结构简式分别为![]() 、
、![]() 、
、 和
和  。
。
(5)基于逆合成分析法,观察信息①,X可从肽键分拆得 和CH3COCH2COOR,那么关键在于合成CH3COCH2COOR,结合信息②可知利用乙酸某酯CH3COOR做原料合成制得。另一个原料是乙醇,其合成乙酸某酯,先将乙醇氧化为乙酸,然后乙酸与乙醇反应,可得乙酸乙酯。以上分析便可将整个合成路线设计为:CH3CH2OH
和CH3COCH2COOR,那么关键在于合成CH3COCH2COOR,结合信息②可知利用乙酸某酯CH3COOR做原料合成制得。另一个原料是乙醇,其合成乙酸某酯,先将乙醇氧化为乙酸,然后乙酸与乙醇反应,可得乙酸乙酯。以上分析便可将整个合成路线设计为:CH3CH2OH![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3![]() CH3COCH2COOCH2CH3
CH3COCH2COOCH2CH3
 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列方程式正确的是
A. MnO2与浓盐酸反应的离子方程式:MnO2+4HCl![]() Mn2++Cl2↑+2Cl-+2H2O
Mn2++Cl2↑+2Cl-+2H2O
B. FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2==2Fe3++I2+4Cl-
C. 向硫酸氢钠溶液中逐滴滴加氢氧化钡溶液至恰好中和: 2H+ + SO42- + Ba2+ + 2OH- == BaSO4↓+ 2H2O
D. 向Na2SiO3溶液中通入过量CO2:SiO32- + CO2 + H2O == H2SiO3↓ + CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究工业尾气处理副产品X(黑色固体,仅含两种元素)的组成和性质,设计并完成如下实验:

请回答:
(1)X含有的两种元素是__________,其化学式是____________。
(2)无色气体D与氯化铁溶液反应的离子方程式是____________________。
(3)已知化合物X能与稀盐酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),写出该反应的化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器。两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2![]() N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
A. 平均反应速率A>B
B. 平衡时NO2的物质的量B>A
C. 平衡时NO2的转化率A>B
D. 平衡时N2O4的物质的量B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响。

已知:2NO2(g)![]() N2O4(g) ΔH=-52.7 kJ·mol-1
N2O4(g) ΔH=-52.7 kJ·mol-1
(1)该化学反应的浓度平衡常数的表达式为_______________。
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答:
①加入浓硫酸的烧杯中溶液温度________,A中的现象为____________________
②由上述实验现象可知,降低温度,该反应化学平衡向________(选填“正”或“逆”)反应方向移动。
③升高温度,该反应的化学平衡常数将________(选填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )

A. 甲为C,X为O2 B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2 D. 甲为AlCl3,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,若W原子最外层电子数是其内层电子总数的3/5。下列说法中,正确的是

A. X只有一种氧化物
B. 气态氢化物的稳定性Z>W
C. 原子半径由大到小排列顺序Z>Y>X
D. 元素X是自然界中形成化合物种类最多的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某化学兴趣小组在实验室用如下装置制备氯气:

请回答:
(1)写出A装置中制取氯气的化学方程式____________________。
(2)若要制备纯净、干燥的氯气,需在A、B之间添加净化装置D、E,其中导管连接的顺序是____________________ (填写数字编号)。
II.某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,实验室设计了方案对废液进行以下三步处理,并回收金属。

请回答:
(1)步骤①中得到的沉淀含有的金属单质有__________。
(2)步骤②是将Fe2+转化为Fe3+,还可以选用的试剂是_____。
A.Fe粉 B.NaOH溶液 C.新制氯水 D.稀硫酸
(3)步骤③中加入氨水生成红褐色沉淀的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示,回答下列问题:

(1)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有______任写两种)。
(2)FeSO4溶液与 NH4HCO3溶液反应的离子方程式是________。
(3)TiO2+水解为TiO(OH)2沉淀的离子方程式为__________,需要加入Na2CO3粉末的目的是__________________________________________。
(4)常温下,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-) = 3.0×10-6 mol/L,需要控制溶液pH____________时,才能使所得的FeCO3中不含Fe(OH)2。(已知:Ksp[FeCO3] = 3.0×10-11,Ksp[Fe(OH)2] = 1.0×10-16)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com