
【题目】为探究工业尾气处理副产品X(黑色固体,仅含两种元素)的组成和性质,设计并完成如下实验:

请回答:
(1)X含有的两种元素是__________,其化学式是____________。
(2)无色气体D与氯化铁溶液反应的离子方程式是____________________。
(3)已知化合物X能与稀盐酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),写出该反应的化学方程式________________________________________。
【答案】Fe、S Fe2S3 SO2 + 2Fe3+ + 2H2O = 2Fe2+ + SO42- + 4H+ Fe2S3 + 4HCl = 2H2S↑+ 2FeCl2 + S↓
【解析】
本题考查化学反应流程图、离子反应方程式的书写及物质的推断等知识。根据向B加入KSCN溶液后,C为血红色溶液为突破口,可以推知B为FeCl3,C为Fe(SCN)3,可知A为Fe2O3,且n(Fe2O3) = 32g/160g/mol = 0.2 mol,n(Fe) = 0.4 mol,m(Fe) = 0.4mol![]() 56g/mol = 22.4g,X燃烧生成的无色气体D,D使FeCl3溶液变为浅绿色,再加BaCl2生成白色沉淀,可知含有X中含有S元素。再根据各元素的质量求出个数比,据此分析作答。
56g/mol = 22.4g,X燃烧生成的无色气体D,D使FeCl3溶液变为浅绿色,再加BaCl2生成白色沉淀,可知含有X中含有S元素。再根据各元素的质量求出个数比,据此分析作答。
(1)B加入KSCN,C为血红色溶液,可以知道B为FeCl3,C为Fe(SCN)3等,可知A为Fe2O3,且n(Fe2O3) = 32g/160g/mol = 0.2 mol,n(Fe) = 0.4 mol,m(Fe) = 0.4mol![]() 56g/mol = 22.4g,X燃烧生成的无色气体D,D使FeCl3溶液变为浅绿色,再加BaCl2生成白色沉淀,可知含有X中含有S元素,且m(S) = 41.6g-22.4g = 19.2g,n(S)=
56g/mol = 22.4g,X燃烧生成的无色气体D,D使FeCl3溶液变为浅绿色,再加BaCl2生成白色沉淀,可知含有X中含有S元素,且m(S) = 41.6g-22.4g = 19.2g,n(S)= ![]() = 0.6mol,可以知道n(Fe):n(S) = 2:3,应为Fe2S3,故答案为:Fe、S;Fe2S3;
= 0.6mol,可以知道n(Fe):n(S) = 2:3,应为Fe2S3,故答案为:Fe、S;Fe2S3;
(2)无色气体D为SO2,与氯化铁发生氧化还原反应,离子方程式为SO2 + 2Fe3+ + 2H2O = 2Fe2+ + SO42- + 4H+,故答案为:SO2 + 2Fe3+ + 2H2O = 2Fe2+ + SO42- + 4H+;
(3)化合物X能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518g/L,淡黄色不溶物为S,气体的相对分子质量为1.518×22.4L=34,为H2S气体,该反应的化学方程式为Fe2S3 + 4HCl = 2H2S↑+ 2FeCl2 + S↓,故答案为:Fe2S3 + 4HCl = 2H2S↑+ 2FeCl2 + S↓


科目:高中化学 来源: 题型:
【题目】下列实验操作可达到实验目的的是
A. 用长颈漏斗可分离乙酸乙酯和饱和碳酸钠溶液
B. 将NaOH溶液滴加到FeCl3溶液中可制备Fe(OH)3胶体
C. 用浓盐酸和MnO2反应制备纯净的Cl2,气体产物先通过浓硫酸再通过饱和食盐水
D. 除去Na2CO3固体中的NaHCO3,可将固体加热至恒重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从工业废钒中回收金属钒既避免污染环境又有利于资源综合利用。某工业废钒的主要成分为V2O5、VOSO4和SiO2等,下图是从废钒中回收钒的一种工艺流程:

(1)为了提高“酸浸”效率,可以采取的措施有________(填两种).
(2)“还原”工序中反应的离子方程式为________.
(3)“沉钒”得到NH4VO3沉淀,需对沉淀进行洗涤,检验沉淀完全洗净的方法是________.
(4)写出流程中铝热反应的化学方程式________.
(5)电解精炼时,以熔融NaCl、CaCl2和VCl2为电解液(其中VCl2以分子形式存在).粗钒应与电源的________极(填“正”或“负”)相连,阴极的电极反应式为________.
(6)为预估“还原”工序加入H2C2O4的量,需测定“酸浸”液中VO2+的浓度.每次取25.00mL“酸浸”液于锥形瓶用a mol/L(NH4)2Fe(SO4)2标准溶液和苯代邻氨基苯甲酸为指示剂进行滴定(其中VO2+ VO2+),若三次滴定消耗标准液的体积平均为bmL,则VO2+的浓度为________g/L(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。查阅资料知体系中存在两个主要反应:
反应i:H2O2(aq) + 2I-(aq) + 2H+(aq) I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
反应ii:I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol
(1)H2O2与S2O32-反应的热化学方程式为______。
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为0.01 mol/L)。
a.向酸化的H2O2溶液中加入________溶液,溶液几秒后变为蓝色。
b._________,溶液立即褪色。
(3)探究c(H+)对反应速率的影响,实验方案如下表所示。(所用试剂除H2O以外,浓度均为0.01 mol/L)
实验序号 | a | b | |
试 剂 | H2O2/mL | 5 | ______ |
H2SO4/mL | 4 | 2 | |
Na2S2O3/mL | 8 | _____ | |
KI(含淀粉)/mL | 3 | _____ | |
H2O | 0 | ______ | |
将上述溶液迅速混合 观察现象 | 溶液变蓝所需时间 为t1秒 | 溶液变蓝所需时间 为t2秒 | |
① 将实验b补充完整。
② 对比实验a和实验b,t1_____t2(填“>”或“<”)。
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因________。
④ 利用实验a的数据,计算t1时间内H2O2与S2O32-反应的平均反应速率(用H2O2浓度的变化表示)________mol/(L·s)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为1.0L的密闭容器中通入1.0 mol N2和x mol H2发生如下反应N2(g)+3H2(g)![]() 2NH3(g),20 min后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,容器内的压强变为原来的80%。请回答下列问题:
2NH3(g),20 min后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,容器内的压强变为原来的80%。请回答下列问题:
(1)20 min内,υ(N2)=____________________。
(2)该反应的热化学方程式为______________________________。
(3)下列叙述中能表示该反应达到平衡状态的是_________(填序号)。
①N2体积分数保持不变
②单位时间断裂0.3 mol H-H键,同时生成0.6 mol N-H键
③混合气体的密度不再改变
④2υ正(H2)=3υ逆(NH3)
⑤混合气体的平均摩尔质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,C和水在密闭容器中发生下列反应:C(s)+H2O(g)![]() CO(g)+H2(g),CO(g)+H2O(g)
CO(g)+H2(g),CO(g)+H2O(g)![]() CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为
CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为
A. 0.1 mol/L B. 0.9 mol/L C. 1.8 mol/L D. 1.9 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成除草剂苯达松和染料中间体X。
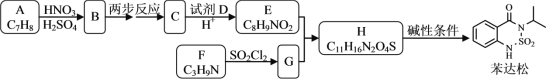
已知信息:①![]() +RCOOR′
+RCOOR′![]()
![]()
②RCH2COOR′+R′′COOR′′′![]()
![]()
(1)下列说法正确的是________。
A.化合物B到C的转变涉及到取代反应
B.化合物C具有两性
C.试剂D可以是甲醇
D.苯达松的分子式是C10H10N2O3S
(2)化合物F的结构简式是________。
(3)写出E+G→H的化学方程式________。
(4)写出C6H13NO2同时符合下列条件的同分异构体的结构简式________。
①分子中有一个六元环,且成环原子中最多含2个非碳原子;
②1HNMR谱和IR谱检测表明分子中有4种化学环境不同的氢原子。有N-O键,没有过氧键(-O-O-)。
(5)设计以CH3CH2OH和 原料制备X(
原料制备X( )的合成路线(无机试剂任选,合成中须用到上述①②两条已知信息,用流程图表示)________。
)的合成路线(无机试剂任选,合成中须用到上述①②两条已知信息,用流程图表示)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸碱中和滴定实验的说法正确的是

A. 用图B的滴定管可准确量取25.00 mL的酸性KMnO4溶液
B. 滴定过程中,眼睛要时刻注视滴定管中液面的变化
C. 滴定管装入液体前不需用待装液润洗
D. 滴定前平视,滴定结束后仰视读数,会使测定结果偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com