
【题目】NH4Al(SO4)2是常见的焙烤食品添加剂;NH4HSO4在医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+) ________(填“等于”“大于”或“小于”) 0.1mol/L NH4HSO4中c(NH4+)。
0.1mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线如图甲所示:

(2)图甲中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填字母)。
(3)向100mL 0.1mol/L NH4Al(SO4)2溶液中滴入90ml 0.5mol/L NaOH溶液,产生白色沉淀__________克。
(4)写出NH4HSO4溶液中滴加足量NaOH溶液的化学方程式______________________________;
25℃时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图乙所示。

(5)试分析图乙中a、b、c、d四个点,水的电离程度最大的是__________。
【答案】 小于 A 0.39g NH4HSO4+NaOH = NH3·H2O+Na2SO4+H2O a
【解析】分析:(1). NH4Al(SO4)2中Al3+水解使溶液呈酸性,抑制NH4+的水解,HSO4-电离出H+同样抑制NH4+水解;(2). NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;(3). n[NH4Al(SO4)2]=0.1L×0.1mol/L=0.01mol,n(NaOH)=0.09L×0.5mol/L=0.045mol,0.01molAl3+转化为氢氧化铝沉淀需要0.03molNaOH,0.01mol NH4+消耗0.01molNaOH,则剩余0.045mol-0.03mol-0.01mol=0.005molNaOH可溶解氢氧化铝沉淀;(4). 铵根离子、氢离子均与碱反应;(5). a、b、c、d四个点,根据反应物之间量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3·H2O,((NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,b点溶液呈中性。
详解:(1). NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出的H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,故答案为:小于;
(2). NH4Al(SO4)2水解使溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为A,故答案为:A;
(3). n[NH4Al(SO4)2]=0.1L×0.1mol/L=0.01mol,n(NaOH)=0.09L×0.5mol/L=0.045mol,0.01molAl3+转化为氢氧化铝沉淀需要0.03molNaOH,可生成0.01molAl(OH)3沉淀,0.01mol NH4+反应时消耗0.01molNaOH,则剩余0.045mol-0.03mol-0.01mol=0.005molNaOH可溶解氢氧化铝沉淀,由Al(OH)3+NaOH=NaAlO2+2H2O可知,最终生成沉淀为(0.01mol-0.005mol)×78g/mol=0.39g,故答案为:0.39g;
(4). 铵根离子、氢离子均可与NaOH反应,其化学反应方程式为:NH4HSO4+2NaOH=NH3·H2O+Na2SO4+H2O,故答案为:NH4HSO4+2NaOH=NH3·H2O+Na2SO4+H2O;
(5). a点时H+恰好完全反应,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3·H2O,(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,b点溶液呈中性,则a点水的电离程度最大,故答案为:a。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.Mg的摩尔质量是24g
B.用酒精可以萃取碘酒中的碘
C.微生物可以用摩尔作单位
D.胶粒直径在1~100nm,光照胶体有光的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2H、13C、15N、18O、34S等常用作环境分析指示物,下列对它们的说法正确的是
A.34S原子核内的中子数为16B.13C和15N原子核内的质子数相差2
C.16O与18O互称同位素D.2H的核外电子数比1H多一个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2,下列有关判断正确的是(提示:SOCl2中S显![]() 价)
价)
A. 还原剂只有Li
B. SOCl2既是氧化剂又是还原剂
C. 还原产物包括LiCl和S
D. 生成1.12LSO2时,反应转移电子为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杨梅醛是常用的水果型食用香精,其合成路线如下:
已知:(CH3CO)2O是乙酸酐,也可写成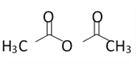 。
。
请回答下列问题:
(1)写出反应类型:①________;③________。
(2)写出反应②的化学方程式:_______________________。
(3)写出两种符合下列条件的![]() 的同分异构体:______。
的同分异构体:______。
i. 含有苯环 ii. 含有醛基:
(4)以下是检验ClCH2COOH中氯元素的实验方案,请把它补充完整。
取少量ClCH2COOH置于试管中,________,加热,_________________,滴加硝酸银溶液,观察是否产生白色沉淀。
(5)根据上述合成路线,设计以CH3COOH和![]() 为原料制备
为原料制备 的合成路线(其它试剂任选)_______。
的合成路线(其它试剂任选)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

请回答下列问题:
(1)装置F中发生反应的离子方程式为_________________________.(提示,高锰酸钾的还原产物为Mn2+)
(2)盛放浓盐酸的装置的名称是___________;A装置中的固体可能是____________.
(3)通入C装置的两根导管左边较长、右边较短,目的是________________________.
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:__________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SOCl2是一种液态化合物,沸点为77℃。有关SOCl2的实验过程如下:
Ⅰ.向盛有10mL蒸馏水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有雾形成,逸出有刺激性气味的气体,该气体通过含有品红的溶液时溶液褪色。
Ⅱ.轻轻振荡锥形瓶,待白雾消失后,往溶液中滴加AgNO3溶液,有白色沉淀产生,再加入HNO3,沉淀不溶解。
请回答:
(1)SOCl2与水反应的化学方程式是________________。
(2)蒸干AlCl3溶液或加热氯化铝的晶体(AlCl3·6H2O)都不能得到无水AlCl3。若使SOCl2与AlCl3·6H2O按恰当比例混合并加热,可得到无水AlCl3,原因是________。
(3)若将AlCl3溶液蒸干,得到的固体是________,继续灼烧,最终得到的固体是________。
(4)若向实验Ⅱ后的浊液中继续滴加KI溶液,现象是________,结合化学用语用平衡移动原理解释其原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明浓HNO3的氧化性比浓H2SO4的氧化性强的事实是
A.浓硝酸加热能放出氧气
B.浓HNO3跟浓盐酸可配制成王水
C.HNO3跟金属反应可生成价态不同的氧化物
D.浓HNO3跟铜剧烈反应且不需加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com