
【题目】杨梅醛是常用的水果型食用香精,其合成路线如下:
已知:(CH3CO)2O是乙酸酐,也可写成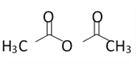 。
。
请回答下列问题:
(1)写出反应类型:①________;③________。
(2)写出反应②的化学方程式:_______________________。
(3)写出两种符合下列条件的![]() 的同分异构体:______。
的同分异构体:______。
i. 含有苯环 ii. 含有醛基:
(4)以下是检验ClCH2COOH中氯元素的实验方案,请把它补充完整。
取少量ClCH2COOH置于试管中,________,加热,_________________,滴加硝酸银溶液,观察是否产生白色沉淀。
(5)根据上述合成路线,设计以CH3COOH和![]() 为原料制备
为原料制备 的合成路线(其它试剂任选)_______。
的合成路线(其它试剂任选)_______。
【答案】 取代反应 取代反应 ClCH2COOH + CH3CH2OH ![]() ClCH2COOCH2CH3 + H2O
ClCH2COOCH2CH3 + H2O ![]() (任写两种即可) 加入NaOH溶液 加入过量硝酸
(任写两种即可) 加入NaOH溶液 加入过量硝酸 
【解析】分析:根据反应前后结构简式变化可知,CH3COOH和Cl2发生取代反应生成ClCH2COOH,在浓硫酸作催化剂、加热的条件下ClCH2COOH和CH3CH2OH发生酯化反应生成ClCH2COOCH2CH3,苯和乙酸酐发生取代反应生成![]() ,
,![]() 和ClCH2COOCH2CH3发生取代反应生成目标产物。
和ClCH2COOCH2CH3发生取代反应生成目标产物。
详解:(1). 通过以上分析知,①、③均为取代反应,故答案为:取代反应;取代反应;
(2). 反应②为ClCH2COOH与CH3CH2OH发生酯化反应生成ClCH2COOCH2CH3和H2O,反应方程式为ClCH2COOH + CH3CH2OH ![]() ClCH2COOCH2CH3 + H2O,故答案为:ClCH2COOH + CH3CH2OH
ClCH2COOCH2CH3 + H2O,故答案为:ClCH2COOH + CH3CH2OH ![]() ClCH2COOCH2CH3 + H2O;
ClCH2COOCH2CH3 + H2O;
(3). 符合题目条件的![]() 的同分异构体有:
的同分异构体有:![]() ,故答案为:
,故答案为:![]() (任写两种即可);
(任写两种即可);
(4). 取少量ClCH2COOH置于试管中,加入NaOH溶液、加热,然后加入过量硝酸中和未反应完的NaOH,最后滴加硝酸银溶液,观察是否产生白色沉淀,如果有白色沉淀说明该物质中含有氯元素,否则不含氯元素,故答案为:加入NaOH溶液;加入过量硝酸;
(5). 以CH3COOH和![]() 为原料制备
为原料制备![]() 时,可以先用CH3COOH和氯气发生取代反应生成ClCH2COOH,ClCH2COOH和CH3OH发生酯化反应生成ClCH2COOCH3,苯发生取代反应生成苯甲醛,苯甲醛和ClCH2COOCH3发生取代反应生成目标产物,其合成路线为:
时,可以先用CH3COOH和氯气发生取代反应生成ClCH2COOH,ClCH2COOH和CH3OH发生酯化反应生成ClCH2COOCH3,苯发生取代反应生成苯甲醛,苯甲醛和ClCH2COOCH3发生取代反应生成目标产物,其合成路线为: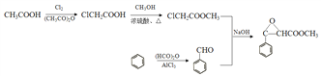 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下面有关钠的化合物的说法中正确的是( )
A.氧化钠与过氧化钠都是碱性氧化物B.氧化钠与过氧化钠都是白色的固体
C.NaHCO3比Na2CO3易溶于水D.Na2CO3比NaHCO3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2;②SiO2;③碘;④金刚石;⑤NaCl;⑥白磷,其中含有两种作用力的组合是
A.①②⑤B.①③⑥C.②④⑥D.①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是
A. 两溶液加入等质量的锌粉,产生氢气的速率相同
B. 两溶液中氢氧根离子浓度均为![]() mol/L
mol/L
C. 加入醋酸钠固体,二者的pH均增大
D. 与氢氧化钠反应至中性时,二者消耗氢氧化钠的质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是常见的焙烤食品添加剂;NH4HSO4在医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+) ________(填“等于”“大于”或“小于”) 0.1mol/L NH4HSO4中c(NH4+)。
0.1mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线如图甲所示:

(2)图甲中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填字母)。
(3)向100mL 0.1mol/L NH4Al(SO4)2溶液中滴入90ml 0.5mol/L NaOH溶液,产生白色沉淀__________克。
(4)写出NH4HSO4溶液中滴加足量NaOH溶液的化学方程式______________________________;
25℃时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图乙所示。

(5)试分析图乙中a、b、c、d四个点,水的电离程度最大的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质:①铁单质 ②二氧化碳 ③氯气 ④硫酸钡晶体 ⑤碳酸氢钠 ⑥盐酸 ⑦氢氧化钠溶液 ⑧乙醇 ⑨熔化的硝酸钾
属于电解质的是___________________(填序号)
(2)请写出下列反应的离子方程式:
⑤与⑦反应:____________________________________________;过量②与⑦反应:_________________________________________
(3)实验室可用下列反应原理制备氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。在该反应中,被还原的物质是__________(填化学式);若反应中生成了4.48L Cl2 (标准状况),则被氧化的HCl为___________mol。
MnCl2+Cl2↑+2H2O。在该反应中,被还原的物质是__________(填化学式);若反应中生成了4.48L Cl2 (标准状况),则被氧化的HCl为___________mol。
(4)工业废水含有Cu2+ 、Ba2+ 、Ag+要求加入三种试剂,每次只沉淀一种离子,写出加入第一种试剂时,所发生反应的离子方程式____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)所得MnO2需充分洗涤,检验是否洗净的方法是________________________。
(2)上述流程脱硫实现了________________________(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(3)加入MnCO3是为了除去溶液中Fe3+和Al3+,检验Fe3+是否完全除掉的试剂为________________。
(4)加入KMnO4充分反应后,溶液酸性明显增强,写出反应的离子方程式______________________。
(5)假设脱除的SO2只与软锰矿浆中MrO2反应。按照图示流程,将a L(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为100%,最终得到MnO2的质量c g,则除去铁、铝、铜、镍等杂质以及外加KMnO4时,所引入的锰元素质量为多少g?_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com