
【题目】物质的量浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是
A. 两溶液加入等质量的锌粉,产生氢气的速率相同
B. 两溶液中氢氧根离子浓度均为![]() mol/L
mol/L
C. 加入醋酸钠固体,二者的pH均增大
D. 与氢氧化钠反应至中性时,二者消耗氢氧化钠的质量相同
【答案】C
【解析】分析:盐酸是强酸,在水溶液中完全电离,醋酸是弱酸,在水溶液中部分电离,所以物质的量浓度均为0.1mol/L的盐酸和醋酸溶液中,c(H+):盐酸>醋酸。
详解:A. 因溶液中c(H+):盐酸>醋酸,所以与Zn反应生成氢气的速率:盐酸>醋酸,故A错误;
B. 盐酸是强酸,在水溶液中完全电离,氢离子浓度为0.1mol/L,所以盐酸溶液中氢氧根离子浓度为1×10-13mol/L,醋酸是弱酸,在水溶液中部分电离,所以氢离子浓度小于0.1mol/L,则醋酸溶液中氢氧根离子浓度大于1×10-13mol/L,故B错误;
C. 向盐酸中加入醋酸钠固体,醋酸钠和盐酸反应生成醋酸,导致溶液中氢离子浓度减小,pH增大,向醋酸中加入醋酸钠,醋酸根离子能抑制醋酸电离,导致溶液中氢离子浓度减小,pH增大,故C正确;
D. 虽然两种酸的浓度相同,但是溶液的体积大小未知,无法判断消耗氢氧化钠的量,故D错误;答案选C。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是

A. “PX”的分子式为C8H10
B. “PX”的二氯代物共有6种(不考虑立体异构)
C. “PX”分子中,最多有14个原子共面
D. 可用酸性KMnO4溶液鉴别“PX”与苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组在实验室利用氨气和新制备的硫酸亚铁溶液反应制备氢氧化亚铁。
(一)制备硫酸亚铁溶液

(1)步骤①,加入稀硫酸的目的是_______。
(2)步骤②,加入还原铁粉后观察到的现象是_______。
(二)制备氢氧化亚铁

(3)选择上图中的装置制备氢氧化亚铁,连接顺序为_______(按气流方向,用装置字母表示)。反应结束后继续通一段时间的N2,目的是_______。
(4)装置B中发生反应的离子方程式是_______。装置C的作用是_______。
(三)探究思考
反应后将装置B中固体过滤时白色沉淀会逐渐转变为灰绿色。在查阅不同资料后,有同学认为灰绿色物质是Fe(OH)2被空气中的氧气氧化后生成的Fe3(OH)8。
(5)Fe3(OH)8中n(Fe2+):n(Fe3+) =_______,用氧化物的形式表示可写成_______。
(6)设计实验证明灰绿色物质中含Fe3(OH)8:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杨梅醛是常用的水果型食用香精,其合成路线如下:
已知:(CH3CO)2O是乙酸酐,也可写成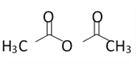 。
。
请回答下列问题:
(1)写出反应类型:①________;③________。
(2)写出反应②的化学方程式:_______________________。
(3)写出两种符合下列条件的![]() 的同分异构体:______。
的同分异构体:______。
i. 含有苯环 ii. 含有醛基:
(4)以下是检验ClCH2COOH中氯元素的实验方案,请把它补充完整。
取少量ClCH2COOH置于试管中,________,加热,_________________,滴加硝酸银溶液,观察是否产生白色沉淀。
(5)根据上述合成路线,设计以CH3COOH和![]() 为原料制备
为原料制备 的合成路线(其它试剂任选)_______。
的合成路线(其它试剂任选)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知: | |
步骤:
| 现象: 待试管b中颜色不变后与试管a比较,溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使![]() 完全反应
完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L HCl完全溶于水得到V mL盐酸,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
①c=![]() ×100% ②c=
×100% ②c=![]() ③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
A. ①④ B. ②③
C. ①③ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com